Гипоплазия легочной артерии у плода на 20 недели
Вы смотрите мобильную версию форума «Доброе Сердце«.
Если Вы не используете мобильное устройство, то настоятельно рекомендую перейти на полную версию форума:
Форум родителей детей и взрослых с врождённым пороком сердца »
ДМЖП, гипоплазия легочной артерии
ВПС, ДМЖП, гипоплазия легочной артерии
NEW! Сообщение отправлено: 20 апреля 2012 19:14
Беременность 20-21 неделя, сегодня мне сделали УЗИ, выявили ВПС: определяются 2ДМЖП ( в нижней трети и субпульмональный) шириной по 2 мм. Расположение магистральных сосудов правильное. Диаметр легочного ствола резко уменьшен, восходящая аорта несколько расширена.
Скоростные показатели в аорте и легочном стволе в пределах нормы. Декстрапозиции аорты и мембранозного ДЖМП нет. Гиперэхогенный фокус в левом желудочке сердца. Правый желодочек умеренно гипоплазирован. Патологии других органов не выявлено.
Заключение УЗИ: ВПС лпода: ДМЖП, гипоплазия легочной артерии.
Пожалуйста, объясните, что означает этот диагноз, что нужно делать, есть ли возможность при данном диагнозе обойтись без операции? Если нет, то в каком возрасте необходимо делать операцию, возможно ли полное выздоровление? Если нет, то какие перспективы у ребенка?
NEW! Сообщение отправлено: 20 апреля 2012 20:54
NEW! Сообщение отправлено: 21 апреля 2012 8:43
Нет, не делали. В понедельник назначено пренатальное кариотипирование. Пеританальный консилиум с участием кардиохирурга. Не знаем, будут ли там еще проверять. но можно ли СЕЙЧАС узнать по этому дагнозу УЗИ, что представляют из себя данные пороки сердца, насколько они тяжелые и что нам дальше делать?
NEW! Сообщение отправлено: 22 апреля 2012 11:50
NEW! Сообщение отправлено: 22 апреля 2012 17:26
Скажите, а что такое генетический анализ. Что он покажет. Для чего он нужен?
До этого были разные анализы крови на отклонения и УЗИ(воротниковая зона), все было нормально.
NEW! Сообщение отправлено: 22 апреля 2012 17:58
NEW! Сообщение отправлено: 27 апреля 2012 4:52
Сегодня был консилиум. Три женщины, председатель, говорят, хороший специалист, стаж 40 лет. Увидела слово «гипоплазия» и сразу сказала: c таким не живут и однозначно прерывание.
Выдала бумажку желтоватого цвета (тираж 1987г.) где написано: «разрешено прерывание беременности на позднем сроке по медицинским показаниям». Одна подпись и одна печать «для листков нетрудоспособности женская консультация»
До этого, разговаривали с тремя кардиохирургами и в разговорах не было такой категоричности.
Да, операция будет нужна, но не экстренная а потом, по состоянию ребенка и может быть что-то изменится до родов в диагнозе.
А диагноз. На первом УЗИ не смогли определить даже пол ребенка. Мы до сих пор этого не знаем.
Есть возможность проконсультироваться у других специалистов, даже в Израиле( можно сбросить по интернету), но нам не дают видео с УЗИ. Делать новое опасно.
Из Израиля звонят: пришлите видео или прилетайте, бесплатно сделаем, так нет загран. паспорта. Паспорт — месяц.
Уважаемая Софья Михайловна, если мне удастся прикрепить файл с диагнозом, может быть что-то посоветуете?
Я понимаю, что все это так, и для реальной оценки необходимо и личное присутствие и новые исследования, но ведь у Вас есть некоторый опыт и может быть у кого то все получилось.
На форуме не нашла.
NEW! Сообщение отправлено: 27 апреля 2012 17:33
Как проявляется гипоплазия легочной артерии?
Гипоплазия легочной артерии представляет собой порок развития легочных сосудов. Он выражается в недоразвитости ветвей легочной артерии или ответвлений. Очень часто такой порок встречается в сочетании с гипоплазией легкого, а также пороками сердца.
Сужение легочной артерии или ее ответвлений является врожденным пороком, который формируется во время внутриутробного развития плода. Такие нарушения могут быть в любой их части, которые отходят от легочного ствола, и появляться на ограниченном участке или иметь большую протяженность.
Сужения сосудов могут быть многочисленными. При этом на концах мелких артерий, в которых возникли сужения, возникают аневризматические расширения, так называемые «слепыми мешками». Места сужения сосудов сопровождаются утолщением их стенок.
Выделяют три формы сужения артерий:
- местное сужение или местное сжатие; сегментарное сужение или удлиненное; диффузное сужение
Обычно гипоплазия сочетается с гипертрофией правого желудочка сердца. Это связано с тем, что для проталкивания крови сквозь суженую часть кровеносного сосуда требуется дополнительное усилие. Это заставляет мышцу правого желудочка работать с большим напряжением. Следствием этого становится увеличение давления в правом желудочке.
Клапан легочной артерии в норме и с пороком
Порок приводит к изменению структуры тканей легкого. При этом конечные отделы легкого увеличиваются. Происходит задержка воздуха, он переполняет альвеолы. Это приводит к росту давления внутри легких и к истончению стенок альвеол. Из-за переполнения воздухом доля легкого значительно увеличивается, снижается эластичность тканей легкого.
Увеличенная доля давит на здоровые участки легкого, они спадают и теряют способность участвовать в воздухообмене.
Типы аномалии
Аномалию подразделяют на несколько типов, основываясь на анатомических особенностях:
- I тип. К нему относят аномалию, при которой наблюдается сужение или сращивание клапана легочной артерии, а ее ствол и ветви нормально развиты. Легочный кровоток проходит через артериальный проток. Почти все ветви артериального сосуда развиты нормально. II тип. Ствол легочной артерии подвержен гипоплазии, а ее ветви нормально развиты. III тип. III A. Аномалия заключается в гипоплазии клапана, ствола, левой ветви легочной артерии. Правая ее ветвь находится в нормальном состоянии и обычно соединяется с открытым артериальным протоком напрямую. III Б. Аномалия состоит в гипоплазии ствола и правой ветви, а также клапана кровеносного сосуда. В то же время уровень развития левой ветви нормальный, она соединена прямо с открытым артериальным протоком.
При этом легкие обеспечивают кровью аортолегочные коллатерали.
- IV тип. Между артерией и правым желудочком нет сообщения. Легочные артерии не участвуют в кровоснабжении. Его обеспечивают коллатерали. Остатки артерий сохраняются в паренхиме легких.
Как выявляют аномалию
Порок легочного кровеносного сосуда, несущего кровь от сердца, относится к внутриутробным аномалиям плода. Она имеет генетическую природу.
Развитию гипоплазии способствуют болезнетворные факторы, влияющие на развитие плода в первом триместре беременности.
Провоцируют развитие аномалии заболевание краснухой, радиационное воздействие, некоторые лекарственные препараты, склонность беременной женщины к алкоголю.
Врач может предположить существование порока, при прослушивании систолического шума над основанием сердца и изменений тонов сердца.
Рентгенологический снимок во время обычного профосмотра может показать чрезмерную прозрачность одного легкого и при этом недоразвитость или отсутствие легочных вен, когда кровоснабжение идет через бронхиальные артерии, ответвления аорты. Подтвердить наличие аномалии можно с помощью следующих методов.
- Рентгеновские снимки. В данном случае метод малоинформативен. При незначительной степени гипоплазии обычно снимок легких не выявляет нарушений. Изменения в сосудах легких редко выявляются при рентгеновском исследовании. Электрокардиограмма. Она информативна при достаточно высокой степени стенозов. В этих случаях диагностика выявляет чрезмерное развитие правых отделов сердца и признаки большой перегрузки правого желудочка и предсердия. Ангиокардиография. Исследование состоит во введения контрастного вещества в полость сердца и в магистральные сосуды, что позволяет подтвердить или опровергнуть характер порока. Она показывает, как много сужений у сосуда, а также степень сужения. Катетеризация. Дает возможность получить информацию о сердечной деятельности и состоянии артерий. Для этого в вену вводят катетер Свана-Ганца, который с током крови продвигается в правую половину сердца — предсердие и желудочек, и в правую или левую легочную артерию и ветви. Метод позволяет измерять внутриполостное давление, получать данные о сосудах малого круга.
Катетеризация может дать полную картину о состоянии сердца
Как проявляется порок
Гипоплазия кровеносного сосуда, несущего кровь от сердца, развитая в незначительной степени, обычно не доставляет человеку неприятностей. Он не испытывает боли и ведет обычный образ жизни.
Если же аномалия развита в значительной степени, человек страдает одышкой, особенно сильно проявляющейся при физической нагрузке.
Он быстро устает, часто болеет респираторными заболеваниями, воспалением легких.
Способы лечения
На сужение легочной артерии приходится 4% пороков сердца. Благодаря методам ангиокардиографии и катетеризации сердца, эта аномалия развития выявляется все чаще.
Дети с диагнозом гипоплазии должны проходить общеоздоровительные мероприятия, заниматься лечебной физкультурой.
Хирургическая коррекция порока – единственный эффективный способ лечения. Специалисты применяют оперативное вмешательство в тех случаях, когда сужение сосудов выявляется в размере большем, чем половина диаметра полости, а разница в давлении достигает 30%. Если сужения легочных артерий многочисленны, их не оперируют.
Во время операции проблемный участок сосуда рассекается и увеличивается его просвет путем заплаты, выполняемой из перикарда больного.
Наиболее часто встречается Клапанный стеноз ствола легочной артерии, возникающий при сращении створок легочного клапана. Нарушение гемодинамики при этом бывает пропорционально степени стеноза.
Повышенная нагрузка на правый желудочек и, соответственно, повышение давления в нем обусловливают возникновение гипертрофии миокарда его стенок.
В наиболее тяжелых случаях перегрузка правого желудочка может приводить к явлениям застойной сердечной недостаточности.
Рассмотренные выше принципы Пренатальной диагностики стеноза аорты могут быть применимы и для стеноза легочной артерии.
До настоящего времени опубликовано только несколько случаев диагностики этого порока во внутриутробном периоде.
В большинстве из них наблюдались его наиболее тяжелые формы, сопровождавшиеся увеличением правого желудочка и/или постстенотическим расширением, либо гипоплазией ствола легочной артерии.
Атрезия ствола легочной артерии с интактной межжелудочковой перегородкой (АСЛА/ИМЖП) у детей обычно сопровождается гипоплазией правого желудочка. Однако в работах, где проводилось обследование плодов, имеются указания на необычно высокую частоту обнаружения увеличения правого желудочка и предсердия.
Хотя случаи выявления данного Порока во внутриутробном периоде немногочисленны, указанное различие по сравнению с обследованием детей может быть обусловлено очень высокой перинатальной смертностью при дилатации правых отделов сердца.
Такое расширение правого предсердия и желудочка, вероятно, формируется вследствие недостаточности трикуспидального клапана.
Пренатальная диагностика данного порока основывается на выявлении сужения легочной артерии в сочетании с атрезией легочного клапана.
Приведенные выше Принципы диагностики синдрома ГЛОС при обследовании в В-режиме в сочетании с допплерографией также применимы и для выявления атрезии ствола легочной артерии с интактной межжелудочковой перегородкой.
Мальформации конотрункуса
Мальформации конотрункуса (нарушения конусостволовой сегментации) представляют собой гетерогенную группу относительно часто встречающихся пороков, при которых поражается два различных сегмента сердца — конотрункус и желудочки. Они составляют 20-30% всех аномалий сердца и являются основной причиной клинически проявляющихся пороков «синего» типа на первом году жизни.
Их пренатальная Диагностика представляет интерес по нескольким причинам. Благодаря наличию у плода путей параллельной циркуляции крови мальформации конотрункуса во внутриутробном периоде гемодинамически хорошо компенсированы.
Клиническая симптоматика обычно манифестирует через несколько часов или дней после рождения, часто бывает тяжелой, требует адекватной экстренной помощи и приводит к значительной заболеваемости и смертности.
Тем не менее, если лечение проведено быстро, прогноз может быть благоприятным.
Обычно Имеются два желудочка нормальных размеров и два главных сосуда, благодаря чему при этих аномалиях существуют условия для бивентрикулярной хирургической коррекции. При этом отдаленный исход бывает гораздо более благоприятным, чем при большинстве других аномалий сердца, выявляемых антенатально.
Первые сообщения о Пренатальной эхокардиографической диагностике мальформации конотрункуса появились в начале 1980-х годов.
Специфическая диагностика требует очень тщательного обследования и иногда оказывается сложна даже для опытного врача ультразвуковой диагностики.
Высокоспециализированные центры, имеющие большой опыт в области фетальной эхокардиографии, сообщают как о ее ложноположительных, так и ложно-отрицательных результатах.
Учебное видео УЗИ сердца плода в норме
Оглавление темы «Диагностика пороков сердца и крупных сосудов плода»:
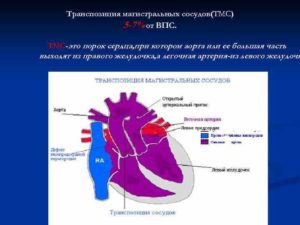
Транспозиция магистральных сосудов: суть ВПС, причины, клиника, лечение, чем грозит
© А. Олеся Валерьевна, к.м.н., практикующий врач, преподаватель медицинского ВУЗа, специально для СосудИнфо.ру (об авторах)
Транспозицией магистральных сосудов (ТМС) называют тяжелую аномалию сердца, когда аорта выходит из правого желудочка (ПЖ), а легочный ствол – из левого.
На долю ТМС приходится до 15-20 % всех врожденных пороков сердца (ВПС), среди больных втрое больше мальчиков.
ТМС входит в число самых частых форм ВПС наряду с тетрадой Фалло, коарктацией аорты, дефектом межжелудочковой перегородки (ДМЖП) и др.
При транспозиции магистральных артерий не происходит обогащения кислородом артериальной крови, так как она движется по замкнутому кругу, минуя легкие. Маленький пациент становится цианотичным сразу после рождения, на лицо явные признаки сердечной недостаточности. ТМС – «синий» порок с выраженной гипоксией тканей, требующий оперативного лечения в первые дни и недели жизни.
Причины ТМС
Точные причины появления патологии у конкретного малыша обычно установить невозможно, ведь мама в период беременности могла подвергаться самым разным неблагоприятным воздействиям. Определенную роль в возникновении этой аномалии могут сыграть:
- Вирусные заболевания в период беременности (краснуха, ветрянка, герпес, респираторные инфекции);
- Тяжелые гестозы;
- Ионизирующее излучение;
- Употребление алкоголя, лекарственных препаратов с тератогенным или мутагенным действием;
- Сопутствующая патология у беременной (диабет, например);
- Возраст мамы старше 35 лет, особенно, если беременность первая.
Замечено, что ТМС чаще возникает у детей с синдромом Дауна, причинами которого становятся хромосомные аномалии, вызываемые перечисленными выше причинами в том числе. У детей с ТМC могут быть диагностированы также пороки и других органов.
Возможно влияние наследственности, хотя точный ген, отвечающий за неправильное развитие сердца, пока не найден. В части случаев причиной становится спонтанная мутация, при этом мама отрицает вероятность внешнего воздействия в виде рентгена, лекарств или инфекций.
Закладка органов и систем происходит в первые два месяца развития эмбриона, поэтому в этот период необходимо оберегать очень чувствительный зародыш от всевозможных токсических факторов. Если сердце начало формироваться неправильно, то потом оно уже не изменится, а признаки порока проявятся сразу же после появления на свет.
Движение крови при ТМС
Хочется подробнее остановиться на том, каким образом кровь движется по полостям сердца и сосудам при их транспозиции, потому что без понимания этих механизмов сложно представить себе суть порока и его проявления.
Особенности кровотока при ТМС определяет наличие двух замкнутых, не связанных между собой кругов кровообращения. Из курса биологии все знают, что сердце «перекачивает» кровь по двум кругам.
Эти потоки разделены, но представляют единое целое. Венозная кровь уходит из ПЖ в легкие, возвращаясь в виде артериальной, обогащенной кислородом, в левое предсердие.
Из ЛЖ в аорту поступает артериальная кровь с кислородом, направляющаяся к органам и тканям.
При ТМС аорта начинается не в левом, а в правом желудочке, а легочный ствол отходит от левого.
Таким образом, получаются два круга, один из который «прогоняет» венозную кровь сквозь органы, а второй – отправляет ее в легкие и получает, по сути, ее же обратно.
В этой ситуации об адекватном обмене речи быть не может, так как оксигенированная кровь не достигает других органов, помимо легких. Такой тип порока называют полной ТМС.
Полную транспозицию у плода обнаружить довольно сложно. При УЗИ сердце будет выглядеть нормальным, четырехкамерным, от него будут отходить два сосуда. Диагностическим критерием порока в данном случае может стать параллельный ход главных артерий, в норме перекрещивающихся, а также визуализация крупного сосуда, который берет начало в левом желудочке и делится на 2 ветви – легочные артерии.
Понятно, что кровообращение нарушается до критического уровня, и без хоть какой-то возможности отправить артериальную кровь к органам не обойтись. На помощь больному маленькому сердцу могут прийти, как ни странно это звучит, другие ВПС.
В частности, пользу окажут дефект в перегородках между предсердиями или желудочками, открытый артериальный проток. Наличие таких дополнительных путей сообщения позволяет соединить оба круга и обеспечить, хоть и минимальную, но все же доставку кислорода к тканям.
Дополнительные пути обеспечивают жизнедеятельность до операции и имеются у 80% больных ТМС.
патологические для взрослого человека пути прохождения крови частично компенсируют порок и имеются у большинства пациентов
Немаловажное значение в отношении клиники и прогноза имеет состояние легочного круга кровотока, наличие или отсутствие его перегрузки кровью. С этой позиции принято выделять разновидности ТМС:
- С перегрузкой или нормальным давлением в легких;
- Со сниженным легочным кровообращением.
У девяти из десяти пациентов находят перегрузку малого круга «лишней» кровью. Причинами этого могут быть дефекты в перегородках, открытый артериальный проток, наличие дополнительных путей сообщения. Обеднение малого круга наступает при сужении выходного отверстия ЛЖ, которое бывает в изолированном виде либо в комбинации с дефектом перегородки желудочков.
Анатомически более сложный порок – корригированная транспозиция магистральных сосудов. В сердце «перепутаны» и камеры, и сосуды, но это позволяет скомпенсировать нарушения кровотока и привести его до приемлемого уровня.
При корригированной ТМС местами меняются оба желудочка с отходящими от них сосудами: левое предсердие переходит в правый желудочек, далее следует аорта, а из правого предсердия кровь движется в ЛЖ и легочный ствол.
Такая «путаница», тем не менее, обеспечивает движение жидкости в нужном направлении и обогащение тканей кислородом.
Полная ТМС (слева) и корригированный порок (справа), фото: vps-transpl.ru
В случае корригированного порока, кровь будет двигаться в физиологическом направлении, поэтому наличия дополнительного сообщения между предсердиями или желудочками не требуется, а если оно есть, то будет играть отрицательную роль, приводя к гемодинамическим нарушениям.
Проявления ТМС
В период внутриутробного развития этот порок сердца никак себя не проявляет, ведь у плода легочный круг не работает. После рождения, когда сердце малыша начинает самостоятельно перекачивать кровь в легкие, проявляется в полной мере и ТМС. Если транспозиция корригирована, то клиника скудная, если порок полный – признаки его не заставят себя ждать.
Степень нарушений при полной ТМС зависит от путей сообщения и их размеров. Чем больше крови смешивается в сердце у новорожденных, тем больше кислорода получат ткани.
Оптимальным считается вариант, когда имеются достаточные отверстия в перегородках, а легочная артерия несколько сужена, что предупреждает перегрузку объемом легочного круга.
Полная транспозиция без дополнительных аномалий с жизнью несовместима.
Малыши с транспозицией главных сосудов рождаются в срок, с нормальной массой или даже крупные, и уже в первые часы жизни заметны признаки ВПС:
- Сильный цианоз всего тела;
- Одышка;
- Увеличение частоты сердечных сокращений.
Далее стремительно нарастают явления сердечной недостаточности:
- Сердце увеличивается в размерах;
- Появляется жидкость в полостях (асцит, гидроторакс);
- Увеличивается печень;
- Возникают отеки.
Обращают на себя внимание и другие признаки нарушения работы сердца.
Так называемый «сердечный горб» (деформация грудной клетки) вызван увеличением сердца, ногтевые фаланги пальцев утолщаются, малыш отстает в развитии, плохо набирает вес.
Определенные трудности возникают при кормлении, так как ребенку сложно сосать грудь при выраженной одышке. Любое движение и даже плач могут быть невыполнимой задачей для такого младенца.
Если в легкие попадает избыточный объем крови, то появляется склонность к инфекционно-воспалительным процессам, частым пневмониям.
Корригированная форма ТМС протекает куда более благоприятно. В отсутствие других сердечных дефектов клиники транспозиции может не быть вовсе, ведь кровь движется правильно. Ребенок будет правильно расти и развиваться соответственно возрасту, а порок может быть обнаружен случайно по наличию тахикардии, шума в сердце, нарушений проводимоости.
Если корригированная транспозиция сочетается с другими нарушениями, то и симптоматика будет определена ими. Например, при отверстии в межжелудочковой перегородке появится одышка, участится пульс, возникнут признаки недостаточности сердца в виде отеков, увеличения печени. Такие дети страдают пневмониями.
Способы коррекции ТМС
Учитывая наличие анатомических изменений сердца, единственно возможным вариантом лечения порока становится хирургическая операция, и чем раньше она будет проведена, тем меньше необратимых последствий принесет заболевание.
Экстренное вмешательство показано больным с полной ТМС, а перед операцией назначаются препараты простагландинов, препятствующие закрытию артериального протока, позволяющего «смешивать» кровь.
В первые дни жизни малыша возможно проведение операций, обеспечивающих связь кругов кровообращения. Если есть отверстия в перегородках – их расширяют, при отсутствии дефектов – создают.
Операция Рашкинда проводится эндоваскулярно, без проникновения в грудную полость и состоит во введении специального баллона, расширяющего овальное окно.
Это вмешательство дает лишь временный эффект на несколько недель, в течение которых должен быть решен вопрос о радикальном лечении.
Самым правильным и эффективным лечением считают операцию, при которой аорта возвращается в левый желудочек, а легочный ствол – в правый, как они и находились бы в норме. Вмешательство проводят открытым способом, под общим наркозом, продолжительность – от полутора-двух часов и более, в зависимости от сложности порока.
пример операции при ТМС
После того, как малыш погружен в наркоз, хирург рассекает ткани грудной клетки и достигает сердца. К этому моменту налаживается искусственный кровоток, когда роль сердца выполняет аппарат, а кровь дополнительно охлаждается, чтобы предупредить осложнения.
Открыв путь к магистральным артериям и сердцу, врач отсекает оба сосуда несколько выше их прикрепления, примерно посередине длины. В устье легочной артерии подшиваются коронарные, затем сюда же «возвращают» аорту. Легочную артерию фиксируют к участку аорты, оставшемуся на выходе из правого желудочка, с помощью фрагмента перикарда.
Результат операции – нормальное расположение сосудистых трактов, когда аорта выходит из левого желудочка, от нее же начинаются и коронарные артерии сердца, а легочный ствол берет начало в правой половине органа.
Оптимальным сроком для проведения лечения считается первый месяц жизни. Конечно, прожить в ее ожидании можно и дольше, но тогда само вмешательство станет нецелесообразным.
Как известно, левый желудочек толще правого и рассчитан на большую нагрузку давлением. При пороке он атрофируется, так как кровь толкает в малый круг.
Если операцию произвести позже положенного срока, то левый желудочек будет не готов к тому, что придется перекачивать кровь в большой круг кровообращения.
Когда время упущено, и провести восстановление анатомии сердца уже нельзя, есть другой способ скорректировать кровоток. Это так называемая внутрипредсердная коррекция, которая применяется более 25 лет и зарекомендовала себя как эффективный способ лечения ТМС. Она показана детям, которым не была вовремя проведена вышеописанная операция.
Суть внутрипредсердной коррекции состоит в рассечении правого предсердия, удалении его перегородки и вшивании «заплаты», которая направляет венозную кровь из большого круга в левый желудочек,откуда она уходит в легкие, при этом легочные вены возвращают оксигенированную кровь в “правое” сердце и затем – в аномально расположенную аорту. Таким образом, не меняя расположения главных артерий, достигается движение крови в нужном направлении.
Прогноз и результаты лечения
Когда появляется на свет малыш с транспозицией сосудов, его родителей очень волнует вопрос не только проведения операции, но и что будет после, как ребенок станет развиваться и что его ждет в будущем.
При своевременном хирургическом лечении прогноз вполне благоприятен: до 90% и более пациентов живут обычной жизнью, периодически посещая кардиолога и проходя минимум обследований для контроля работы органа.
При сложных пороках ситуация может быть хуже, но все-таки у большинства больных качество жизни приемлемое.
После операции внутрипредсердной коррекции около половины пациентов не испытывают ограничений в жизни, и ее продолжительность довольно высокая.
Другая половина может страдать аритмиями, явлениями сердечной недостаточности, из-за чего рекомендуется ограничить физические нагрузки, а женщин предупреждают о рисках при беременности и родах.
На сегодняшний день, ТМС – вполне излечимая аномалия, и сотни детей и взрослых, благополучно перенесших операцию – тому подтверждение. Многое зависит от родителей, их веры в успех и желания помочь своему малышу.
: ТМС – репортаж 1 канала
© 2012-2020 sosudinfo.ru
Источники
Вывести все публикации с меткой:
Нарушение формирования сосудов и, как результат, гипоплазия легочной артерии
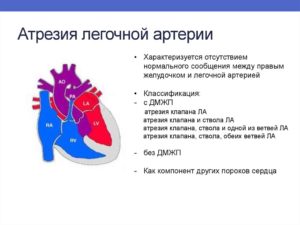
Нарушение формирования легочных артерий (ЛА) у плода связано с воздействием на женщину внутренних и внешних факторов в первые недели беременности. В результате сосуд может быть уменьшенным и тонкостенным (гипоплазия) или отсутствовать (агенезия, аплазия). Возможно бессимптомное течение патологии и тяжелые формы болезни с одышкой и развитием эмфиземы легких.
Для лечения детей с дыхательной недостаточностью применяется баллонное расширение и стентирование.
Причины гипоплазии легочной артерии
Нарушение развития сосудов, отходящих от ствола легочной артерии, могут вызывать такие факторы:
- внешние (экзогенные) – травматические или термические (ожоги) воздействия, влияние электромагнитных волн, радиоактивное облучение, ядовитые вещества, курение, алкоголь, медикаменты, вирусные или бактериальные инфекции;
- внутренние тератогенные – наследственная предрасположенность, генетические аномалии, болезни эндокринной системы, возраст матери и отца свыше 40 лет.
При этом доказано, что достаточно наличия хотя бы одного из этих воздействий в первом триместре беременности для формирования порока развития артерий легких, а при их сочетании риски возрастают в несколько раз.
Рекомендуем прочитать статью о гипоплазии отделов сердца. Из нее вы узнаете о причинах появления гипоплазии отделов сердца, видах, симптомах синдрома у плода, у новорожденных, а также о диагностике состояния и лечении синдрома.
А здесь подробнее о гипоплазии позвоночной артерии.
Что значит гипоплазия и агенезия
При недостаточном развитии сосуда он может быть уже и короче нормального, это снижает скорость движения по нему крови. Такой порок называется гипоплазией ветвей легочной артерии. Если он не сформировался вообще, то аномалия носит название агенезии. Сужение артерии может быть:
- частичным или на всем протяжении;
- одно- и двусторонним;
- одного или нескольких сосудов;
- центральным или периферическим.
При аплазии легочной артерии кровоснабжение обеспечивается открытым артериальным протоком в период внутриутробного развития, коллатералями (соединениями) с аортой, внутренней торакальной артерией, бронхиальными ветвями после рождения. При существенной гипоплазии легочной артерии обычно отмечается утолщение миокарда правых отделов сердца.
Эта патология бывает изолированной достаточно редко. Как правило, обнаруживают сужение клапана ЛА, дефекты перегородок, болезнь Фалло, открытый Боталлов проток. У пациентов также диагностируют аномалии структуры легочной ткани – гипоплазию, кистозные изменения.
Насколько опасно для плода и новорожденного
Во внутриутробном периоде гипоплазия легочных сосудов обычно не нарушает процесса развития плода. После родов патологическое изменение кровообращения проявляется в затруднении выброса крови в легкие из правого желудочка. Если недоразвита мелкая ветвь с одной или двух сторон, то это не нарушает внутрисердечную гемодинамику, а давления в правых отделах сердца не превышает норму.
Распространенная гипоплазия, или агенезия крупной артерии, приводит к появлению следующих симптомов:
- затрудненное дыхание,
- одышка при физической нагрузке,
- повышенная слабость,
- быстрая утомляемость,
- сонливость,
- головокружение,
- обморочные состояния,
- тахикардия,
- недостаточный набор веса,
- замедленный рост,
- частые простудные заболевания,
- рецидивирующие воспаления легких.
Цианотичная окраска кожи для этой аномалии развития не характерна, но она может появиться при сердечной или легочной недостаточности, в связи с сопутствующими врожденными пороками сердца.
Методы диагностики
При осмотре пациента редко можно обнаружить отклонения от нормы, особенно при единичных гипополазированных сосудах. При двустороннем интенсивном сужении просвета артерий бывает акцент второго тона над проекцией легочного ствола и слабый шум на основании сердца в период систолы. При инструментальном обследовании можно обнаружить:
- ЭКГ – норма или признаки перегрузки правых отделов;
- рентгенография грудной клетки – норма или незначительное увеличение дуги правого желудочка, обеднение рисунка легких или его асимметрия при односторонней гипоплазии, уменьшение объема легкого, компенсаторное увеличение противоположного, смещение средостения;
- катетеризация полостей сердца – повышение давления в правых отделах и стволе легочной артерии;
- ангиопульмонография – слабое контрастирование артерии или обрыв сосуда;
- МРТ – снижение кровотока в зоне аномального сосуда, локальные изменения ткани легких.
Гипоплазия левого легкого. Обеднение сосудов слева, уменьшение размеров корня, смещение срединной тени.
Лечение новорожденного
При отсутствии клинических проявлений дети с аномалией строения легочных артерий не нуждаются в лечении. Им рекомендуется избегать чрезмерного физического напряжения, эмоциональных перегрузок, лечебная физкультура и дыхательная гимнастика.
При тяжелой степени недоразвития сосудов проводится стентирование после того, как масса ребенка достигнет 10 кг. При проведении этой операции вначале в просвет сосуда вводится катетер с баллончиком на конце, при достижении нужного места в него подают воздух для расширения просвета, устанавливают металлический каркас, удерживающий стенки в расправленном состоянии.
Если артерии нет (агенезия), то могут быть такие варианты ее реконструкции:
- наложение соустьев между функционирующими сосудами в обход суженного;
- соединение правого желудочка с артериями путем установки трубки из перикарда пациента;
- пластика ксеноперикардиальной заплатой или имплантация ствола из синтетического материала.
Катетеризация легочной артерии
Особую важность приобретают такие операции при наличии сочетанных врожденных пороков сердца, так как они помогают избежать перегрузки правого желудочка и развития гипертензии малого круга кровообращения. При появлении у ребенка выраженной сердечной или легочной недостаточности время для хирургического лечения считается упущенным.
Гипоплазия легочной артерии является врожденным дефектом развития. Вероятность ее возникновения повышается при неблагоприятных внешних воздействиях, заболеваниях матери.
Симптомы при незначительных изменениях могут отсутствовать, если артерия не сформировалась, или процесс носит двусторонний характер, то со временем возникает недостаточность кровообращения, одышка, отставание ребенка в росте и развитии. Эта аномалия строения сосудов может быть причиной хронических болезней легких.
Рекомендуем прочитать статью о гипоплазии сонной артерии. Из нее вы узнаете о причинах гипоплазии, нарушении кровообращения при ней, клинических проявлениях, методах исследования и лечения гипоплазии сонной артерии.
А здесь подробнее о легочной гипертензии.
Для диагностики используют рентгенографию, ангиопульмонографию и МРТ. При клинических проявлениях гипоплазии и агенезии легочной артерии показаны реконструктивные операции.
Смотрите на видео о лечении аортального стеноза эндоваскулярным методом трансапикальным доступом:
Насколько опасен дефект межжелудочковой перегородки у новорожденного?
Человеческое сердце имеет сложное четырехкамерное строение, которое начинает формироваться с первых дней после зачатия.
Но бывают случаи, когда этот процесс нарушается, из-за чего в строении органа возникают крупные и мелкие дефекты, которые влияют на работу всего организма. Один из них носит название дефект межжелудочковой перегородки, или сокращенно ДМЖП.
Описание
Дефект межжелудочковой перегородки – это врожденный (иногда приобретенный) порок сердца (ВПС), который характеризуется наличием патогенного отверстия между полостями левого и правого желудочка. По этой причине кровь из одного желудочка (обычно из левого) поступает в другой, нарушая тем самым функцию сердца и всей системы кровообращения.
Распространенность его составляет примерно 3-6 случаев на 1000 доношенных новорожденных, не считая детей, которые появляются на свет с мелкими дефектами перегородки, которые самостоятельно купируются в течение первых лет жизни.
Среди врожденных пороков ДМЖП занимает второе место по распространенности среди детей старше 3-х лет.
Причины и факторы риска
Обычно дефект межжелудочковой перегородки у плода развивается на ранних этапах беременности, примерно с 3-й по 10-ю неделю. Основной причиной этого считается совокупность внешних и внутренних негативных факторов, включая:
- генетическую предрасположенность;
- вирусные инфекции, перенесенные в период вынашивания ребенка (краснуха, корь, грипп);
- злоупотребление алкоголем и курение;
- прием антибиотиков, оказывающих тератогенное действие (психотропные препараты, антибиотики и т.д.);
- воздействие токсинов, тяжелых металлов и радиации;
- сильные стрессы.
Классификация
Дефект межжелудочковой перегородки у новорожденных и детей постарше может диагностироваться как самостоятельная проблема (изолированный порок), так и как составная часть других сердечно-сосудистых заболеваний, например, пентады Кантрелла (кликните сюда, чтобы почитать о ней).
Размер дефекта оценивается исходя из его величины по отношению к диаметру аортального отверстия:
- дефект размером до 1 см классифицируется как малый (болезнь Толочинова-Роже);
- крупными считаются дефекты от 1 см или те, которые по своим размерам превышают половину устья аорты.
Наконец, по локализации отверстия в перегородке ДМЖП делится на три типа:
- Мышечный дефект межжелудочковой перегородки у новорожденного. Отверстие располагается в мышечной части, в отдалении от проводящей системы сердца и клапанов, и при небольших размерах может закрываться самостоятельно.
- Мембранозный. Дефект локализируется в верхнем сегменте перегородки ниже аортального клапана. Обычно он имеет небольшой диаметр и купируется самостоятельно по мере роста ребенка.
- Надгребневый. Считается самым сложным видом порока, так как отверстие в этом случае находится на границе выводящих сосудов левого и правого желудочка, и самопроизвольно закрывается очень редко.
Опасность и осложнения
При небольшом размере отверстия и нормальном состоянии ребенка ДМЖП не представляет особой опасности для здоровья ребенка, и требует только регулярного наблюдения у специалиста.
Большие дефекты – совсем другое дело. Они являются причиной сердечной недостаточности, которая может развиться сразу же после появления младенца на свет.
Такие дети подвержены простудным заболеваниям со склонностью к пневмонии, могут отставать в развитии, испытывать трудности с сосательным рефлексом, страдать от одышки даже после небольшой физической нагрузки. Со временем трудности с дыханием возникают и в состоянии покоя, из-за чего нарушается работа легких, печени и других органов.
Кроме того, ДМЖП может стать причиной следующих серьезных осложнений:
- синдром Эйзенменгера как последствие легочной гипертензии;
- формирование острой сердечной недостаточности;
- эндокардит, или инфекционное воспаление внутрисердечной оболочки;
- инсульты и образование тромбов;
- нарушение работы клапанного аппарата, которое ведет к формированию клапанных пороков сердца.
Симптомы
Большие дефекты межжелудочковой перегородки проявляются уже в первые дни жизни, и характеризуются следующими симптомами:
- посинение кожных покровов (преимущественно конечностей и лица), усиливающееся во время плача;
- нарушения аппетита и проблемы при кормлении;
- замедленный темп развития, нарушение прибавок веса и роста;
- постоянная сонливость и быстрая утомляемость;
- отеки, локализующиеся в области конечностей и живота;
- нарушения сердечного ритма и одышка.
Малые дефекты часто не имеют ярко выраженных проявлений и определяются при прослушивании (в груди пациента слышен грубый систолический шум) или других исследованиях. В некоторых случаях у детей наблюдается так называемый сердечный горб, то есть выпячивание груди в области сердца.
Если заболевание не было диагностировано в младенческом возрасте, то с развитием сердечной недостаточности у ребенка в 3-4 года появляются жалобы на сильное сердцебиение и боли в груди, развивается склонность к носовым кровотечениям и потерям сознания.
Пациенты часто страдают от застойных явлений в легких, одышки и кашля, сильно устают даже после небольших физических нагрузок.
Когда обращаться к врачу
ДМЖП, как и любой другой порок сердца (даже если он компенсирован и не причиняет неудобств пациенту) обязательно требует постоянного наблюдения кардиолога, так как ситуация в любой момент может ухудшиться.
Чтобы не пропустить тревожные симптомы и время, когда ситуацию можно исправить с наименьшими потерями, родителям очень важно наблюдать за поведением ребенка с первых же дней. Если он слишком много и долго спит, часто капризничает без причины и плохо набирает вес, это является серьезным поводом для консультации с педиатром и детским кардиологом.
У разных ВПС симптомы схожи. Узнайте больше о симптомах врожденных пороков сердца, чтобы не пропустить ни одну жалобу.
Диагностика
К основным методам диагностики ДМЖП относятся:
- Электрокардиограмма. В ходе исследования определяется степень перегрузки желудочков, а также наличие и выраженность легочной гипертензии. Кроме того, у больных старшего возраста могут определяться признаки аритмии и нарушения проводимости сердца.
- Фонокардиография. С помощью ФКГ можно зафиксировать высокочастотный систолический шум в 3-4-м межреберье слева от грудины.
- Эхокардиография. ЭхоКГ позволяет выявить отверстие в межжелудочковой перегородке или заподозрить его наличие, исходя из нарушений кровообращения в сосудах.
- Ультразвуковое исследование. УЗИ оценивает работу миокарда, его структуру, состояние и проходимость, а также два очень важных показателя – давление в легочное артерии и величину сброса крови.
- Рентгенография. На рентгене органов грудной клетки можно увидеть усиление легочного рисунка и пульсации корней легких, значительное увеличение сердца в размерах.
- Зондирование правых полостей сердца. Исследование дает возможность выявить повышенное давление в легочной артерии и желудочке, а также повышенную оксигенацию венозной крови.
- Пульсоксиметрия. Метод определяет степень насыщенности крови кислородом – низкие показатели являются признаком серьезных проблем с сердечно-сосудистой системой.
- Катетеризация сердечной мышцы. С ее помощью врач оценивает состояние структур сердца и определяет давление в его камерах.
Дифференциальная диагностика проводится с дефектом аортолегочной перегородки, стенозом легочной артерии и аорты, недостаточностью митрального клапана, тромбоэмболией и другими пороками и заболеваниями сердечно-сосудистой системы.
Лечение
Маленькие дефекты перегородки, которые не дают ярко выраженных симптомов, обычно не требуют какого-либо специального лечения, так как самостоятельно затягиваются к 1-4 годам жизни или позже.
В сложных случаях, когда отверстие не зарастает в течение долгого времени, наличие дефекта сказывается на самочувствии ребенка или он слишком велик, ставится вопрос о хирургическом вмешательстве.
При подготовке к операции применяется консервативное лечение, помогающее регулировать сердечный ритм, нормализовать давление и поддержать работу миокарда.
Хирургическая коррекция ДМЖП может быть паллиативной или радикальной: паллиативные операции проводят грудным детям с выраженной гипотрофией и множественными осложнениями в целях подготовки к радикальному вмешательству. В этом случае врач создает искусственный стеноз легочной артерии, который значительно облегчает состояние пациента.
К радикальным операциям, которые применяются для лечения ДМЖП, относятся:
- ушивание патогенных отверстий П-образными швами;
- пластика дефектов с помощью заплат из синтетической или биологической ткани, выполняющаяся под контролем УЗИ;
- операции на открытом сердце эффективны при комбинированных пороках (например, тетраде Фалло) или крупных отверстиях, которые невозможно закрыть с помощью одной заплаты.
Самые лучшие результаты дают хирургические вмешательства, проведенные в возрасте 2-2,5 лет, когда у пациентов обычно появляются первые признаки сердечной недостаточности.
В этом видео рассказано об одном из наиболее эффективных операций против ДМЖП:
Прогнозы и профилактика
Небольшие дефекты межжелудочковой перегородки (1-2 мм) обычно имеют благоприятный прогноз – дети с таким заболеванием не страдают от неприятных симптомов и не отстают в развитии от своих сверстников. При более значительных дефектах, сопровождающихся сердечной недостаточностью, прогноз значительно ухудшается, так как без соответствующего лечения они могут привести к серьезным осложнениям и даже летальному исходу.
Профилактических мер для предупреждения ДМЖП следует придерживаться еще на этапе планирования беременности и вынашивания ребенка: они заключаются в ведении здорового образа жизни, своевременном посещении женской консультации, отказе от вредных привычек и самолечения.
Несмотря на серьезные осложнения и не всегда благоприятные прогнозы, диагноз «дефект межжелудочковой перегородки» нельзя считать приговором маленькому пациенту. Современные методики лечения и достижения кардиохирургии позволяют значительно улучшить качество жизни ребенка и продлить ее настолько, насколько это возможно.
7 Комментариев
Атрезия легочной артерии с дефектом межжелудочковой перегородки. Клинические рекомендации
- атрезия легочной артерии
- стеноз легочной артерии
- коллатеральные артерии
- отсутствие легочной артерии
- дефект межжелудочковой перегородки
АВ – артерио-венозный
АКГ – ангиокардиография
АЛА – атрезия легочной артерии
БАЛКА – большие аорто-легочные коллатеральные сосуды
ВА – вено-артериальный сброс
ВПС – врожденный порок сердца
ДЛА – давление в легочной артерии
ДМЖП – дефект межжелудочковой перегородки
ДМПП – дефект межпредсердной перегородки
КТ – компьютерная томография
ЛА – легочная артерия
ЛГ – легочная гипертензия
МРТ – магнитно-резонансная томография
ОАП – открытый артериальный проток
ОЛС – общелегочное сопротивление
ОПС – общепериферическое сопротивление
ПП – правое предсердие
ПЖ – правый желудочек
СИБКК – сердечный индекс большого круга кровообращения
ТФ – тетрада Фалло
ЭКГ – электрокардиография
ЭхоКГ — эхокардиография
Sat O2 – насыщение крови кислородом
Термины и определения
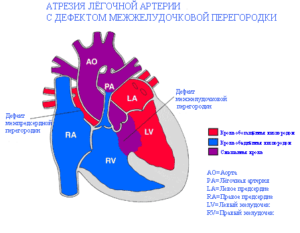
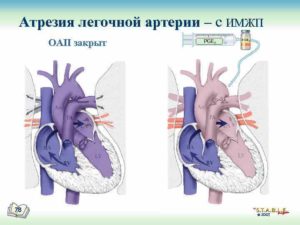
Атрезия легочной артерии – отсутствие сообщения между правым желудочком и системой легочной артерии в зависимости от типа порока.
Коллатеральные сосуды – аномальные сосуды от аорты или ее ветвей осуществляющие дополнительный кровоток в легких.
Дефект межжелудочковой перегородки – анатомическое сообщение между правым и левым желудочками сердца.
Эндокардит — воспаление внутренней оболочки сердца, является частым проявлением других заболеваний.
Эхокардиография — метод ультразвукового исследования, направленный на исследование морфологических и функциональных изменений сердца и его клапанного аппарата.
1.1. Определение
Атрезия легочной артерии (АЛА) представляет собой врожденное отсутствие прямого сообщения междуправым желудочком ( ПЖ) и системой легочной артерии (ЛА). Это довольно редкий ВПС, который отмечается в 2–3% случаев от всех ВПС.
Порок встречается как в виде сочетания с дефектом межжелудочковой перегородки (ДМЖП), так и с различными сложными ВПС, такими как транспозиция магистральных сосудов, атрезия правого атриовентрикулярного отверстия, единственный желудочек сердца и др..
Анатомические критерии порока следующие: 1) отсутствие ЛА на различных уровнях; 2) большой ДМЖП; 3) наличие дополнительных источников коллатерального кровотока легких; 4) гипертрофия ПЖ; 5) декстропозиция корня аорты; 6) нормальное взаимоотношение аорты и ствола ЛА [1, 2].
1.2 Этиология и патогенез
АЛА с ДМЖП является врожденным пороком сердца, при этом состояние ребенка, в основном, зависит от величины открытого артериального протока (ОАП), наличия больших аорто-легочных коллатеральных артерий.
Нарушения гемодинамики при данном пороке определяются главным образом отсутствием прямого сообщения между ПЖ и системой ЛА, при этом прямое поступление венозной крови из ПЖ невозможно.
Кровоток в легких осуществляется обходным путем из ПЖ через ДМЖП в левый желудочек (ЛЖ), далее смешанная артериализированная кровь поступает в аорту и лишь затем через ОАП или по коллатеральным сосудам в легкие. При этом насыщение крови кислородом в аорте, коллатеральных артериях и легочной артерии идентично [5, 6].
1.3 Эпидемиология
Заболеваемость составляет 3-5% от всех ВПС.
Смертность. Прогноз жизни пациента зависит от характера легочного кровотока. Смертность детей с дуктус-зависимой гемодинамикой до 12 месяцев составляет 90%.
У пациентов, имеющих несколько источников легочного кровотока и умеренно выраженный цианоз к 3-5 летнему возрасту смертность составляет 50%.
При усиленном легочном кровотоке и наличии больших аорто-легочных коллатеральных артерий больные умирают по мере развития легочной гипертензии преимущественно в третьей декаде жизни. В целом медиана выживаемости больных с АЛА и ДМЖП находится в пределах 6 мес. – 2 лет.
1.4 Кодирование по МКБ 10
Q22.0 — Атрезия легочной артерии с дефектом межжелудочковой перегородки:
1.5. Классификация
По классификации J. Somerville [3], выделяют четыре типа порока:
- Атрезия клапана ЛА. Ствол, правая и левая легочные артерии полностью сформированы и проходимы;
- II. Атрезия клапана и ствола ЛА. Обе легочные артерии сохранены и могут иметь общее или раздельное начало;
- III. Атрезия клапана, ствола и одной из легочных артерий. Другая легочная артерия сформирована и проходима;
- IV. Атрезия клапана, ствола, обеих легочных артерий. Кровоток в легких осуществляется за счет сети коллатеральных сосудов.
Существует более современная классификация порока, принятая на 3й Международной конференции по разработке номенклатуры для детской кардиохирургии в New Orleans в 1999 г.,
Классификация малого круга кровообращения:
- тип А – имеются истинные легочные артерии, коллатеральные артерии отсутствуют, легочный кровоток осуществляется через ОАП;
- тип Б – наличие истинных легочных и коллатеральных артерий;
- тип В – истинные легочные артерии отсутствуют, легочный кровоток осуществляется по коллатеральным артериям.
Классификация порока в зависимости от типа атриовентрикулярной и вентрикулоартериальной связи:
- конкордантная атрио-вентрикулярная и вентрикулоартериальная связь;
- конкордантная атриовентрикулярная и дискордантная вентрикулоартериальная связь;
- дискордантная атриовентрикулярная и конкордантная вентрикулоартериальная связь;
- дискордантная атриовентрикулярная и вентрикулоартериальная связь.
Типы коллатерального кровообращения легких при АЛА:
- большие аортолегочные коллатеральные артерии;
- ОАП;
- медиастинальные артерии;
- бронхиальные артерии;
- фистула между левой коронарной артерией и стволом ЛА;
- смешанные формы. Наиболее значительную роль в обеспечении кровотока в легких играют открытый артериальный проток, БАЛКА и бронхиальные артерии [4].
2.1. Жалобы и анамнез
- При сборе анамнеза и жалоб рекомендуется расспросить пациента о наличии одышки, синюшности губ и кончиков пальцев, рекомендуется обратить внимание на отставание больных в физическом развитии, на присаживание на корточки.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – IIa)