Генетические факторы риска невынашивания и осложнений беременности. Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)
array(19) { [«catalog_code»]=> string(6) «180036» [«name»]=> string(417) «Генетические факторы риска невынашивания и осложнений беременности.
Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3547» [«url»]=> string(78) «geneticheskije-faktory-riska-nevynashivanija-i-oslozhnenij-beremennosti-180036» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи, можно пить воду без газа.
» [«opisanie»]=> string(16861) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Невынашивание беременности — одна из самых актуальных проблем современного акушерства. Частота невынашивания беременности составляет от 10 до 25 % всех беременностей.
Одной из ведущих причин невынашивания беременности ранних сроков являются различные генетические факторы, причем помимо хромосомных перестроек невынашивание беременности может возникать как результат экспрессии функционально ослабленных вариантов (полиморфизмов) вышеперечисленных генов на фоне неблагоприятных внешних и внутренних факторов.
Выявление генетических полиморфизмов при планировании беременности позволяет минимизировать возможные опасные последствия, обусловленные индивидуальными генетическими особенностями женщины.
На сегодняшний день используется целая группа лекарственных препаратов еще на этапе планирования беременности (препараты, препятствующие агрегации тромбоцитов, антикоагулянты, полиненасыщенные жирные кислоты, антиоксиданты, фолиевая кислота и витаминно-минеральные комплексы), вероятность благополучного исхода беременности высока и при правильном и своевременном лечении достигает 95%.
В данной панели исследуются различные факторы, обусловливающие генетическую предрасположенность к невынашиванию и осложнениям беременности.
Ген F2 кодирует протромбин (коагуляционный фактор II), ген F5 кодирует коагуляционный фактор V – оба белка являются ключевыми компонентами свертывающей системы крови.
Вариации в данных генах обусловливают генетическую предрасположенность к повышенному тромбообразованию.
При наличии фактора риска в гене F2 повышен риск развития таких осложнений как невынашивание беременности, фетоплацентарная недостаточность, внутриутробная гибель плода, токсикоз, задержка развития плода и отслойка плаценты.
Наиболее опасным периодом в плане развития тромбозов глубоких вен во время беременности является конец второго — третий триместр и ранний послеродовый период. При наличии изменений в гене F5 повышен риск развития преэклампсии, отслойки нормально расположенной плаценты, ранней потери беременности, привычного невынашивания.
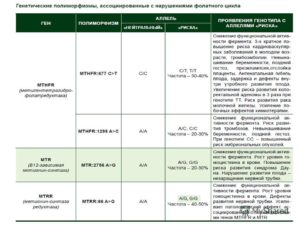
Определенную роль в невынашивании беременности могут играть гены, принимающие участие в метаболизме фолиевой кислоты и витамина В12. Высокие концентрации активной формы фолиевой кислоты необходимы для превращения гомоцистеина в метионин.
Основными генами, продукты которых контролируют превращение фолиевой кислоты в метаболически активные формы и регулируют обмен гомоцистеина, являются MTHFR(метилентетрагидрофолатредуктаза), MTRR (метионинсинтетазредуктаза), MTR (метионинредуктаза).
Полиморфизмы в этих генах связаны со снижением активности соответствующих ферментов и могут приводить к накоплению гомоцистеина.
Повышенный уровень гомоцистеина при беременности может приводить к нарушениям фетоплацентарного кровообращения, хронической гипоксии плода, задержке внутриутробного развития, преэклампсии, отслойки плаценты, развитию врожденного порока Spina bifida. При дополнительном действии других неблагоприятных факторов возможно самопроизвольное прерывание беременности на ранних сроках, в ряде случаев — привычное невынашивание беременности.
Ген FGB кодирует фибриноген — белок, предшественник фибрина, присутствующий в плазме крови.
Под влиянием фермента тромбина из фибриногена образуется нерастворимый белок фибрин на заключительном этапе свертывания крови, что образует основу фибринового тромба.
Исследуемая вариация в гене FGB ассоциирована с повышением уровня фибриногена плазмы крови, и, как следствие, повышением риска развития преэклампсии, отслойки нормально расположенной плаценты и развития акушерских осложнений.
Изменение гена SERPINE1 приводит к повышению концентрации белка ингибитора активатора плазминогена и обусловливает повышенную склонность к тромбозу.
Наличие фактора риска связано с повышенным риском отслойки хориона и плаценты в ранние сроки беременности и, по некоторым литературным данным, с повышенным риском ранней потери беременности, особенно в сочетании с дополнительными отягощающими факторами.
Ген ESR1 кодирует рецептор эстрогена альфа. Гормон участвует в регуляции полового развития, гаметогенеза, роста и поддержания скелета, функционировании сердечно-сосудистой и нервной систем.
Изменения гена приводят к снижению выработки эстрогенового рецептора, вызывая риск невынашивания беременности, акушерских осложнений, а полиморфизм T>C (PvuII), кроме того, дает неблагоприятный прогноз для осуществления ЭКО.
Полиморфизм в гене AGT, кодирующем ангиотензиноген, приводит к повышению концентрации ангиотензиногена в крови, повышая риск развития преэклампсии во время беременности. У женщин — носителей аллеля риска С повышен риск развития инфаркта миокарда и других сердечно — сосудистых событий на фоне гормоно-заместительной терапии (ГЗТ).
Гестационный диабет – повышенное содержание глюкозы в крови, возникающее во время беременности. При возникновении гестационного сахарного диабета на начальных сроках беременности значительно возрастает риск самопроизвольного аборта, врожденных пороков развития сердца и мозговых структур плода.
На поздних сроках (2-3й триместры), гестационный диабет приводит к чрезмерному росту плода (макросомии) и гиперинсулинемии, а после рождения может проявиться заболеванием внутренних органов плода (диабетической фетопатией). Ген TCF7L2 кодирует фактор, регулирующий рост, деление и развитие клеток поджелудочной железы.
Исследуемый генетический вариант ассоциирован с повышенным риском развития гестационного диабета (диабета беременных).
Показания к исследованию:
- Всем женщинам при плановой подготовке к беременности;
- При наличии в анамнезе двух и более прерываний беременности на ранних сроках, тяжёлых осложнений беременности (гестоз, задержка развития плода, внутриутробная гибель плода), неудачных попытках ЭКО;
- При назначении оральных гормональных контрацептивов, заместительной гормональной терапии (при выявлении генетической предрасположенности к тромбозам назначение данной категории препаратов противопоказано!);
- При подготовке к ЭКО;
- При низком уровне половых гормонов (эстрогенов).
Интерпретация результатов:
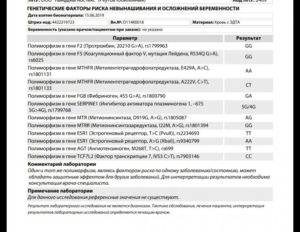
Пример результата исследования. Генетические факторы риска невынашивания и осложнений беременности
| Полиморфизм в гене F2 (протромбин, 20210 G>A), rs1799963 | GG |
| Полиморфизм в гене F5 (коагуляционный фактор V, мутация Лейдена, R534Q G>A), rs6025 | GG |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, E429A, A>C) rs1801131 | AA |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133 | TT |
| Полиморфизм в гене FGB (фибриноген, 455 G>A) rs1800790 | AA |
| Полиморфизм в гене SERPINE1 (ингибитор активатора плазминогена 1, –675 5G>4G, rs1799768) | 5G/5G |
| Полиморфизм в гене MTR (Метионинсинтаза, D919G, A>G) rs1805087 | AA |
| Полиморфизм в гене MTRR (Метионинсинтазаредуктаза, I22M, A>G) rs1801394 | AA |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, T>C (PvuII)), rs2234693 | TС |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, A>G (XbaI)) rs9340799 | AG |
| Полиморфизм в гене AGT (Ангиотензиноген, M268T, T>C), rs699 | CC |
| Полиморфизм в гене TCF7L2 (Фактор транскрипции 7, IVS3 C>T) rs7903146 | CC |
Анализ на генетику при беременности — что показывает и зачем нужен
Во время генетического анализа специалисты-генетики изучают гены, которые отвечают за передачу наследственных данных от родителей ребенку. Они рассчитывают вероятный результат зачатия, определяют доминантные признаки плода, а также возможные заболевания с пороками развития.
Идеальным вариантом считается обращение к генетику на этапе планирования беременности.
Что показывает генетический анализ при беременности
Анализ на генетику при беременности проводится, чтобы вы могли узнать информацию:
- обладают ли будущие родители генетической совместимостью;
- риск наследственной предрасположенности малыша к определенным болезням;
- имеются ли у матери и ребенка инфекционные возбудители;
- генетический паспорт лица, где находится комбинированный анализ ДНК, отражающий сведения о неповторимости конкретного лица.
Перечисленные данные помогут предупредить нарушения со здоровьем малыша.
Отдельное внимание следует уделить генетическому обследованию при замершей беременности. Иногда именно из-за врожденной тромбофилии случается многократное невынашивание ребенка.
Повторные случаи неразвивающегося плодного яйца у женщины – повод отправить материал на определение кариотипа с хромосомным набором эмбриона.
Специалист может исследовать содержание у беременной ИЛ-4: при замирании плода уровень цитокинов снижен.
Зачем и на каком сроке сдавать анализ
После возникновения хромосомной мутации изменяется структура молекулы ДНК, формируется плод с тяжелейшими аномалиями. Чтобы предотвратить патологию, врачи рекомендуют планировать беременность с проведением генетических тестов, демонстрирующих почти 100% точность подтверждения нарушений развития плода.
Для оценки внутриутробного развития специалисты проводят ультразвуковую диагностику и биохимический тест. Они не представляют никакой угрозы для здоровья или жизни малыша.
Первое УЗИ беременная проходит на сроке 10-14 недель, второе – 20-24 недели. Врач обнаруживает даже незначительные дефекты крохи.
На 10-13 и 16-20 недель будущие мамы сдают генетическую двойку: так называется анализ крови на ХГЧ и РАРР-А.
Если после применения перечисленных методов специалист выявляет патологию развития, назначаются инвазивные тесты.
Они выполняются в следующие периоды гестации:
- Биопсия хориона: на сроке 10-12 недель.
- Амниоцентез: 15-18 недель.
- Плацентоцентез: 16-20 недель.
- Кордоцентез: по завершении 18 недель.
Показания к проведению анализа
Выполнение генетического теста обязательно, если беременная включается в группу риска:
- будущая мама превышает 35-летний возраст;
- у будущей мамы уже рождались дети с врожденными аномалиями или отклонениями;
- в предыдущей беременности женщина перенесла опасные инфекции;
- наличие продолжительного времени алкогольной или наркотической зависимости перед наступлением оплодотворения;
- наличие случаев самопроизвольного выкидыша или мертворождения.
Группа повышенного риска
Существует определенная категория дам, которым показана обязательная консультация генетика:
- Будущая мама не достигла 18 лет или возраст превысил 35 лет.
- Наличие болезней наследственного характера.
- Женщины, родившие ребенка с аномалиями развития.
- Имеющие в прошлом или нынешнее время любой вид зависимости – алкогольной, наркотический, табачной.
- Пары, страдающие опасными инфекциями – ВИЧ, гепатит, беременные перенесшие краснуху, ветрянку, герпес на начальных сроках гестации.
- Будущая мама, которая принимала лекарственные средства, нежелательные для применения во время вынашивания ребенка.
- Получившие дозу облучения в начале гестации из-за прохождения флюорографии или рентгенологического обследования.
- Занимавшиеся в молодые годы экстремальным спортом женщины.
- Будущие мамы, принявшие высокую дозу УФ-облучения.
Иногда женщина не знает о произошедшем зачатии, подвергаясь действию неблагоприятных факторов. Поэтому риск попадания в группу риска появляется у многих беременных.
Подготовительные меры
Как подготовиться? Перед сдачей крови постарайтесь с утра не есть или пройдите тест по прошествии 5 часов после еды.
Для подготовки к УЗИ абдоминальным методом за 30 минут до исследования выпейте пол-литра обычной воды, чтобы наполнить мочевой пузырь. За 1-2 дня придерживайтесь диеты.
Откажитесь от употребления продуктов, вызывающих брожение: капуста, виноград, черный хлеб, газированные напитки.
Если потребуется провести вагинальное обследование, заранее примите душ, а перед процедурой опорожните мочевой пузырь.
Как делают генетический анализ — методы проведения исследований
Генетик подробно изучает родословную будущих родителей, оценивает риск наследственных заболеваний. Специалист учитывает профессиональную сферу, экологические условия, влияние лекарственных средств, принимаемых незадолго до визита к доктору.
Врач проводит исследование кариотипа, который необходим для будущей мамы с отягощенным анамнезом. Оно дает возможность проанализировать качественный и количественный хромосомный состав женщины. Если родители – близкие кровные родственники или случалось невынашивание беременности, необходимо провести HLA-типирование.
Генетик проводит неинвазивные методы диагностики врожденных аномалий развития плода – УЗИ и тесты на биохимические маркеры.
К последним относятся:
- определение содержания ХГЧ;
- анализ крови на РАРР-А.
Американской компанией был запатентован еще 1 тест. На 9 неделе будущая мама сдает венозную кровь, где содержится наследственная информация – ДНК ребенка. Специалисты подсчитывают число хромосом, а при наличии патологии выявляются ряд синдромов – Дауна, Эдварса, Патау, Тернера, Ангельмана.
Если неинвазивные исследования обнаруживают аномалии, специалист проводит инвазивное обследование. С их помощью осуществляют забор материала, определяют с высокой точностью кариотип малыша для исключения наследственной патологии – синдрома Дауна, Эдварда.
К таким методам относятся:
- Биопсия хориона. Врач проводит прокол передней брюшной стенки, а затем берет клетки формирующейся плаценты.
- Амниоцентез. Берут пункцию амниотической жидкости, оценивают ее цвет, прозрачность, клеточный и биохимический состав, объем, уровень гормонов. Процедура считается наиболее безопасной из инвазивных диагностических методов, но требует немало времени для получения заключения. Обследование выявляет аномалии, появившиеся во время беременности, оценивает уровень развития плода.
- Кордоцентез. Исследование заключается в проведении пункции пуповины с забором крови ребенка. Метод является точным, а результаты становятся известны через несколько дней.
- Плацентоцентез. Осуществляется анализ плацентарных клеток.
В результате проведенных тестов специалист составляет для родителей генетический прогноз. На его основании можно предугадать вероятность появления врожденных патологий у малыша, наследственных заболеваний. Врач разрабатывает рекомендации, помогающие планировать нормальную беременность, а если зачатие уже произошло, определяет, стоит ли ее сохранять.
АзбукаРодов советуют: Подписывайтесь на наш канал
Мутация генов гемостаза: проявления и последствия

Гемостаз – система организма, которая отвечает за нормальную остановку кровотечений и свертываемость крови. Функционирование гемостаза зависит от состояния стенок сосудов, от количества тромбоцитов в крови и некоторых других факторов.
Различные мутации генов гемостаза могут привести к патологиям развития плода, связанным с нарушением свертываемости крови и не только. Они являются причиной хронического не вынашивания беременности, выкидышей на поздних сроках и других негативных последствий, поэтому важно пройти своевременное обследование.
В каких случаях необходимо обследование на мутации генов гемостаза?
Мутация генов гемостаза
Мутации (полиморфизм) генов – достаточно распространенное явление, поэтому анализы желательно сдавать в нескольких случаях:
- Если женщина подбирает оптимальный метод гормональной контрацепции или проходит заместительную гормональную терапию. Проверка позволит выбрать безопасный метод и не повредить способности к зачатию в дальнейшем.
- Если женщина обращается к врачу по поводу бесплодия или постоянного не вынашивания беременности. О мутациях генов гемостаза могут свидетельствовать многократные неудачные попытки ЭКО, поздние токсикозы, задержки развития плода, токсикоз на поздних сроках и т. д. Даже одного из этих признаков достаточно для того, чтобы было назначено обследование.
- Если имелись случаи тромбозов при возрасте до 50 лет. Особенно это касается курящих мужчин и лиц, у близких родственников которых наблюдались случаи тромбозов глубоких вен инфаркты миокарда и инсульты.
Сдать анализы желательно перед плановыми хирургическими операциями: трансплантацией, эндопротеззированием и т. д.
Нарушение свертываемости крови в процессе серьезного вмешательства может привести к грозным осложнениям и гибели больного.
Если у молодого человека присутствует нарушение слуха, установить причину которого не удается. Это основные случаи, при которых требуется провериться на наличие нарушений в системе гемостаза.
Различные мутации могут оставаться незамеченными в течение многих лет, так как они протекают совершенно бессимптомно и могут возникать внезапно. Однако в критический для организма момент, например, во время беременности или при хирургической операции может обнаружиться нарушение свертываемости крови, способное привести к гибели плода и другим серьезным последствиям.
Причины возникновения мутаций гемостаза
Мутации генов гемостаза могут быть врожденными – они передаются поколениями по нисходящей линии. Из-за этого обязательно нужно проходить проверку, если тромбозы и несвертываемость крови встречались у близких родственников. Однако есть и приобретенные мутации, которые могут возникать под воздействием различных факторов.
Одной из причин является антифосфолипидный синдром – это аутоиммунное заболевание, при котором в организме начинают вырабатываться антитела к собственным фосфолипидам.
Аутоимунные проблемы возникают нечасто, однако мутации гемостаза могут возникать и по другим причинам:
- Постоянные стрессы. Они снижают сопротивляемость организма инфекциям, кроме того, при постоянном перенапряжении нарушаются различные функции организма.
- Онкологические или эндокринные заболевания. Отчасти они могут быть связаны с экологической обстановкой: доказано, что в определенных районах раковые опухоли и различные мутации генов встречаются чаще из-за загрязнения природы вследствие деятельности человека.
- Употребление лекарственных препаратов, в том числе гормональных. Обследование желательно проводить перед приемом гормональных контрацептивов, чтобы избежать их негативного влияния на организм.
из которого можно узнать что такое гемостаз.
Причин возникновения мутаций достаточно много: в дополнительной группе риска окажутся люди с выраженным ожирением, к их появлению могут привести некоторые виды травм.
До сих пор точно неизвестно, по какому именно принципу возникают мутации того или иного гена, однако сейчас медицина научилась сводить к минимуму последствия такого полиморфизма.
Важно при появлении подозрений сдать анализы, причем сделать это рекомендуется еще на этапе планирования беременности.
Основные гены гемостаза, в которых возникают мутации
Виды генов в которых может возникнуть мутация
При обращении в клинику пациенту предлагают пройти комплексное обследование. Анализ на полиморфизм проводится в отношении следующих генов:
- G20210A – ген протромбинов. Его мутации проявляются врожденными тромбофилиями, возможны тромбозы различных сосудов, значительно увеличивается риск инфарктов и инсультов. Прием контрацептивных препаратов в несколько раз повышает риск образования тромбов. У беременных мутация этого гена проявляется не вынашиванием плода, отслойкой плаценты, задержками развития плода.
- G1691A –мутация Лейдена, проявляющаяся изменениями гена 5 фактора. Симптомы можно назвать аналогичными, для этого вида мутаций характерна гибель плода в течение второго и третьего триместра.
- FGB G455A – мутации генов фибриногена. Их проявлениями могут стать тромбозы глубоких вен и тромбоэмболии, не вынашивание плода, привычные аборты на ранних и поздних сроках.
- MTRR и MTHFR – гены метаболизма фолиевой кислоты. Их мутации могут привести к порокам развития нервной системы у плода, сердца, сосудов, урогенитального аппарата. Обследование, выявляющее такие мутации, рекомендуется пройти всем женщинам, планирующим беременность и находящимся в группе риска.
- MTHFR C677T – еще один ген метаболизма фолиевой кислоты. Если в нем возникают мутации, нарушается работа фермента метилентетрагидрофолатредуктаза, преобразующего гомоцистеин в метионин. Если наблюдается этот процесс, почти в 1,5-2 раза повышается риск развития атеросклероза, увеличивается вероятность рождения плода с отклонениями нервной системы. У детей может наблюдаться анэнцефалия, глубокая умственная отсталость и другие варианты поражения.
- GPIa C807T –ген гликопротеина. Мутации проявляются тромбозами и тромбоэмболиями, повышается риск инфарктов миокарда и инсультов в молодом возрасте. Мутационные изменения передаются по наследству, поэтому такой фактор нужно обязательно учитывать при планировании беременности, особенно если уже имели место выкидыши.
- PAI-1 4G/5G – ген, отвечающий за ингибитор активатора плазминогена. Мутации становятся причиной выкидышей на ранних и поздних сроках, гестозов, отслойки плаценты и других негативных последствий. Своевременное выявление мутаций позволяет снижать риск их проявления в период беременности и во время родов.
Есть и еще некоторые гены, состояние которых подлежит анализу в ходе исследования. В зависимости от его результатов пара сможет принять решение о том, стоит ли планировать беременность, которая с высокой долей вероятности будет проходить с опасными осложнениями. Такое решение дается нелегко, но нужно трезво оценить степень риска и принять обдуманное взвешенное решение.
Как проводится исследование генов гемостаза?
Сдача анализа на гемостаз
Работоспособность системы гемостаза может анализироваться несколькими способами: в качестве анализного материала может использоваться капиллярная и венозная кровь, сдавать образцы необходимо натощак. Желательно заранее узнать график работы лаборатории и воздержаться накануне от употребления острой или соленой пищи, чтобы не исказились результаты анализов.
Сейчас есть еще один способ получения материала для анализа: в некоторых клиниках используется защечный мазок, позволяющий получить клетки эпителия обратной стороны щеки.
Такой метод является совершенно безболезненным и очень быстрым, это возможность провести обследование без дискомфорта даже для людей, боящихся уколов.
После проведения лабораторных исследований назначается консультация специалиста-гематолога, который подробно объяснит полученный результат.
Анализ проводится методом ПЦР (полимеразной цепной реакции), результат определяется с помощью контрольных образцов.
При проведении лабораторных исследований учитывается тот факт, что во время беременности всегда незначительно повышается уровень свертываемости крови, и это не является патологией. Однако наличие мутаций усиливает этот процесс, и начавшиеся тромбозы способны причинить большой вред организму матери и ребенка.
Чтобы проверить, передается ли мутация по наследству, рекомендуется сдать генетический анализ. Это недешевая процедура, дающая возможность определить вероятность дальнейших отклонений в системе гемостаза у потомков.
Этот вид анализов обязательно назначается людям, в роду которых уже имелись случаи тромбоза.
Бить тревогу нужно обязательно: не выявленная вовремя мутация способна привести к гибели плода или тяжелым порокам в его физическом и умственном развитии.
Возможна ли коррекция нарушений?
Возможно ли успешное завершение беременности и нормальное развитие плода, если были выявлены какие-либо мутации генов гемостаза? Да, современные методы медицины помогают бороться с повышенной свертываемостью крови и предотвращают плацентарную недостаточность пороки развития плода. В этом случае назначается фолиевая кислота, препятствующая образованию тромбов, специальные поливитамины и различные иные препараты. Если точно соблюдать врачебные рекомендации, шанс выносить здорового ребенка и успешно родить без осложнений повышается до 95%.
Выявление нарушений в работе системы гемостаза не является приговором для больного. Есть специальные лекарственные средства, способные предупредить тромбозы и минимизировать последствия хромосомных отклонений.
Даже если у женщины несколько раз не получалось доносить беременность, после начала правильного лечения, можно значительно увеличить шансы на успех.
Успехи лабораторных методов исследования позволили получать максимально точную информацию о правильности набора хромосом и возможных отклонениях. Сейчас медицина позволяет «вести» весь процесс беременности, своевременно корректируя любые отклонения. Если вовремя обратиться к специалистам и воспользоваться профессиональной помощью, риск пороков развития можно свести к минимуму.
Генетические анализы при потерях беременности

Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.
Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Генетические факторы риска невынашивания и осложнений беременности. Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)


array(19) { [«catalog_code»]=> string(6) «180036» [«name»]=> string(417) «Генетические факторы риска невынашивания и осложнений беременности.
Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3547» [«url»]=> string(78) «geneticheskije-faktory-riska-nevynashivanija-i-oslozhnenij-beremennosti-180036» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи, можно пить воду без газа.
» [«opisanie»]=> string(16861) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Невынашивание беременности — одна из самых актуальных проблем современного акушерства. Частота невынашивания беременности составляет от 10 до 25 % всех беременностей.
Одной из ведущих причин невынашивания беременности ранних сроков являются различные генетические факторы, причем помимо хромосомных перестроек невынашивание беременности может возникать как результат экспрессии функционально ослабленных вариантов (полиморфизмов) вышеперечисленных генов на фоне неблагоприятных внешних и внутренних факторов.
Выявление генетических полиморфизмов при планировании беременности позволяет минимизировать возможные опасные последствия, обусловленные индивидуальными генетическими особенностями женщины.
На сегодняшний день используется целая группа лекарственных препаратов еще на этапе планирования беременности (препараты, препятствующие агрегации тромбоцитов, антикоагулянты, полиненасыщенные жирные кислоты, антиоксиданты, фолиевая кислота и витаминно-минеральные комплексы), вероятность благополучного исхода беременности высока и при правильном и своевременном лечении достигает 95%.
В данной панели исследуются различные факторы, обусловливающие генетическую предрасположенность к невынашиванию и осложнениям беременности.
Ген F2 кодирует протромбин (коагуляционный фактор II), ген F5 кодирует коагуляционный фактор V – оба белка являются ключевыми компонентами свертывающей системы крови.
Вариации в данных генах обусловливают генетическую предрасположенность к повышенному тромбообразованию.
При наличии фактора риска в гене F2 повышен риск развития таких осложнений как невынашивание беременности, фетоплацентарная недостаточность, внутриутробная гибель плода, токсикоз, задержка развития плода и отслойка плаценты.
Наиболее опасным периодом в плане развития тромбозов глубоких вен во время беременности является конец второго — третий триместр и ранний послеродовый период. При наличии изменений в гене F5 повышен риск развития преэклампсии, отслойки нормально расположенной плаценты, ранней потери беременности, привычного невынашивания.
Определенную роль в невынашивании беременности могут играть гены, принимающие участие в метаболизме фолиевой кислоты и витамина В12. Высокие концентрации активной формы фолиевой кислоты необходимы для превращения гомоцистеина в метионин.
Основными генами, продукты которых контролируют превращение фолиевой кислоты в метаболически активные формы и регулируют обмен гомоцистеина, являются MTHFR(метилентетрагидрофолатредуктаза), MTRR (метионинсинтетазредуктаза), MTR (метионинредуктаза).
Полиморфизмы в этих генах связаны со снижением активности соответствующих ферментов и могут приводить к накоплению гомоцистеина.
Повышенный уровень гомоцистеина при беременности может приводить к нарушениям фетоплацентарного кровообращения, хронической гипоксии плода, задержке внутриутробного развития, преэклампсии, отслойки плаценты, развитию врожденного порока Spina bifida. При дополнительном действии других неблагоприятных факторов возможно самопроизвольное прерывание беременности на ранних сроках, в ряде случаев — привычное невынашивание беременности.
Ген FGB кодирует фибриноген — белок, предшественник фибрина, присутствующий в плазме крови.
Под влиянием фермента тромбина из фибриногена образуется нерастворимый белок фибрин на заключительном этапе свертывания крови, что образует основу фибринового тромба.
Исследуемая вариация в гене FGB ассоциирована с повышением уровня фибриногена плазмы крови, и, как следствие, повышением риска развития преэклампсии, отслойки нормально расположенной плаценты и развития акушерских осложнений.
Изменение гена SERPINE1 приводит к повышению концентрации белка ингибитора активатора плазминогена и обусловливает повышенную склонность к тромбозу.
Наличие фактора риска связано с повышенным риском отслойки хориона и плаценты в ранние сроки беременности и, по некоторым литературным данным, с повышенным риском ранней потери беременности, особенно в сочетании с дополнительными отягощающими факторами.
Ген ESR1 кодирует рецептор эстрогена альфа. Гормон участвует в регуляции полового развития, гаметогенеза, роста и поддержания скелета, функционировании сердечно-сосудистой и нервной систем.
Изменения гена приводят к снижению выработки эстрогенового рецептора, вызывая риск невынашивания беременности, акушерских осложнений, а полиморфизм T>C (PvuII), кроме того, дает неблагоприятный прогноз для осуществления ЭКО.
Полиморфизм в гене AGT, кодирующем ангиотензиноген, приводит к повышению концентрации ангиотензиногена в крови, повышая риск развития преэклампсии во время беременности. У женщин — носителей аллеля риска С повышен риск развития инфаркта миокарда и других сердечно — сосудистых событий на фоне гормоно-заместительной терапии (ГЗТ).
Гестационный диабет – повышенное содержание глюкозы в крови, возникающее во время беременности. При возникновении гестационного сахарного диабета на начальных сроках беременности значительно возрастает риск самопроизвольного аборта, врожденных пороков развития сердца и мозговых структур плода.
На поздних сроках (2-3й триместры), гестационный диабет приводит к чрезмерному росту плода (макросомии) и гиперинсулинемии, а после рождения может проявиться заболеванием внутренних органов плода (диабетической фетопатией). Ген TCF7L2 кодирует фактор, регулирующий рост, деление и развитие клеток поджелудочной железы.
Исследуемый генетический вариант ассоциирован с повышенным риском развития гестационного диабета (диабета беременных).
Показания к исследованию:
- Всем женщинам при плановой подготовке к беременности;
- При наличии в анамнезе двух и более прерываний беременности на ранних сроках, тяжёлых осложнений беременности (гестоз, задержка развития плода, внутриутробная гибель плода), неудачных попытках ЭКО;
- При назначении оральных гормональных контрацептивов, заместительной гормональной терапии (при выявлении генетической предрасположенности к тромбозам назначение данной категории препаратов противопоказано!);
- При подготовке к ЭКО;
- При низком уровне половых гормонов (эстрогенов).
Интерпретация результатов:
Пример результата исследования. Генетические факторы риска невынашивания и осложнений беременности
| Полиморфизм в гене F2 (протромбин, 20210 G>A), rs1799963 | GG |
| Полиморфизм в гене F5 (коагуляционный фактор V, мутация Лейдена, R534Q G>A), rs6025 | GG |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, E429A, A>C) rs1801131 | AA |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133 | TT |
| Полиморфизм в гене FGB (фибриноген, 455 G>A) rs1800790 | AA |
| Полиморфизм в гене SERPINE1 (ингибитор активатора плазминогена 1, –675 5G>4G, rs1799768) | 5G/5G |
| Полиморфизм в гене MTR (Метионинсинтаза, D919G, A>G) rs1805087 | AA |
| Полиморфизм в гене MTRR (Метионинсинтазаредуктаза, I22M, A>G) rs1801394 | AA |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, T>C (PvuII)), rs2234693 | TС |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, A>G (XbaI)) rs9340799 | AG |
| Полиморфизм в гене AGT (Ангиотензиноген, M268T, T>C), rs699 | CC |
| Полиморфизм в гене TCF7L2 (Фактор транскрипции 7, IVS3 C>T) rs7903146 | CC |
Анализ на генетику при беременности — что показывает и зачем нужен

Во время генетического анализа специалисты-генетики изучают гены, которые отвечают за передачу наследственных данных от родителей ребенку. Они рассчитывают вероятный результат зачатия, определяют доминантные признаки плода, а также возможные заболевания с пороками развития.
Идеальным вариантом считается обращение к генетику на этапе планирования беременности.
Что показывает генетический анализ при беременности
Анализ на генетику при беременности проводится, чтобы вы могли узнать информацию:
- обладают ли будущие родители генетической совместимостью;
- риск наследственной предрасположенности малыша к определенным болезням;
- имеются ли у матери и ребенка инфекционные возбудители;
- генетический паспорт лица, где находится комбинированный анализ ДНК, отражающий сведения о неповторимости конкретного лица.
Перечисленные данные помогут предупредить нарушения со здоровьем малыша.
Отдельное внимание следует уделить генетическому обследованию при замершей беременности. Иногда именно из-за врожденной тромбофилии случается многократное невынашивание ребенка.
Повторные случаи неразвивающегося плодного яйца у женщины – повод отправить материал на определение кариотипа с хромосомным набором эмбриона.
Специалист может исследовать содержание у беременной ИЛ-4: при замирании плода уровень цитокинов снижен.
Зачем и на каком сроке сдавать анализ
После возникновения хромосомной мутации изменяется структура молекулы ДНК, формируется плод с тяжелейшими аномалиями. Чтобы предотвратить патологию, врачи рекомендуют планировать беременность с проведением генетических тестов, демонстрирующих почти 100% точность подтверждения нарушений развития плода.
Для оценки внутриутробного развития специалисты проводят ультразвуковую диагностику и биохимический тест. Они не представляют никакой угрозы для здоровья или жизни малыша.
Первое УЗИ беременная проходит на сроке 10-14 недель, второе – 20-24 недели. Врач обнаруживает даже незначительные дефекты крохи.
На 10-13 и 16-20 недель будущие мамы сдают генетическую двойку: так называется анализ крови на ХГЧ и РАРР-А.
Если после применения перечисленных методов специалист выявляет патологию развития, назначаются инвазивные тесты.
Они выполняются в следующие периоды гестации:
- Биопсия хориона: на сроке 10-12 недель.
- Амниоцентез: 15-18 недель.
- Плацентоцентез: 16-20 недель.
- Кордоцентез: по завершении 18 недель.
Показания к проведению анализа
Выполнение генетического теста обязательно, если беременная включается в группу риска:
- будущая мама превышает 35-летний возраст;
- у будущей мамы уже рождались дети с врожденными аномалиями или отклонениями;
- в предыдущей беременности женщина перенесла опасные инфекции;
- наличие продолжительного времени алкогольной или наркотической зависимости перед наступлением оплодотворения;
- наличие случаев самопроизвольного выкидыша или мертворождения.
Группа повышенного риска
Существует определенная категория дам, которым показана обязательная консультация генетика:
- Будущая мама не достигла 18 лет или возраст превысил 35 лет.
- Наличие болезней наследственного характера.
- Женщины, родившие ребенка с аномалиями развития.
- Имеющие в прошлом или нынешнее время любой вид зависимости – алкогольной, наркотический, табачной.
- Пары, страдающие опасными инфекциями – ВИЧ, гепатит, беременные перенесшие краснуху, ветрянку, герпес на начальных сроках гестации.
- Будущая мама, которая принимала лекарственные средства, нежелательные для применения во время вынашивания ребенка.
- Получившие дозу облучения в начале гестации из-за прохождения флюорографии или рентгенологического обследования.
- Занимавшиеся в молодые годы экстремальным спортом женщины.
- Будущие мамы, принявшие высокую дозу УФ-облучения.
Иногда женщина не знает о произошедшем зачатии, подвергаясь действию неблагоприятных факторов. Поэтому риск попадания в группу риска появляется у многих беременных.
Подготовительные меры
Как подготовиться? Перед сдачей крови постарайтесь с утра не есть или пройдите тест по прошествии 5 часов после еды.
Для подготовки к УЗИ абдоминальным методом за 30 минут до исследования выпейте пол-литра обычной воды, чтобы наполнить мочевой пузырь. За 1-2 дня придерживайтесь диеты.
Откажитесь от употребления продуктов, вызывающих брожение: капуста, виноград, черный хлеб, газированные напитки.
Если потребуется провести вагинальное обследование, заранее примите душ, а перед процедурой опорожните мочевой пузырь.
Как делают генетический анализ — методы проведения исследований
Генетик подробно изучает родословную будущих родителей, оценивает риск наследственных заболеваний. Специалист учитывает профессиональную сферу, экологические условия, влияние лекарственных средств, принимаемых незадолго до визита к доктору.
Врач проводит исследование кариотипа, который необходим для будущей мамы с отягощенным анамнезом. Оно дает возможность проанализировать качественный и количественный хромосомный состав женщины. Если родители – близкие кровные родственники или случалось невынашивание беременности, необходимо провести HLA-типирование.
Генетик проводит неинвазивные методы диагностики врожденных аномалий развития плода – УЗИ и тесты на биохимические маркеры.
К последним относятся:
- определение содержания ХГЧ;
- анализ крови на РАРР-А.
Американской компанией был запатентован еще 1 тест. На 9 неделе будущая мама сдает венозную кровь, где содержится наследственная информация – ДНК ребенка. Специалисты подсчитывают число хромосом, а при наличии патологии выявляются ряд синдромов – Дауна, Эдварса, Патау, Тернера, Ангельмана.
Если неинвазивные исследования обнаруживают аномалии, специалист проводит инвазивное обследование. С их помощью осуществляют забор материала, определяют с высокой точностью кариотип малыша для исключения наследственной патологии – синдрома Дауна, Эдварда.
К таким методам относятся:
- Биопсия хориона. Врач проводит прокол передней брюшной стенки, а затем берет клетки формирующейся плаценты.
- Амниоцентез. Берут пункцию амниотической жидкости, оценивают ее цвет, прозрачность, клеточный и биохимический состав, объем, уровень гормонов. Процедура считается наиболее безопасной из инвазивных диагностических методов, но требует немало времени для получения заключения. Обследование выявляет аномалии, появившиеся во время беременности, оценивает уровень развития плода.
- Кордоцентез. Исследование заключается в проведении пункции пуповины с забором крови ребенка. Метод является точным, а результаты становятся известны через несколько дней.
- Плацентоцентез. Осуществляется анализ плацентарных клеток.
В результате проведенных тестов специалист составляет для родителей генетический прогноз. На его основании можно предугадать вероятность появления врожденных патологий у малыша, наследственных заболеваний. Врач разрабатывает рекомендации, помогающие планировать нормальную беременность, а если зачатие уже произошло, определяет, стоит ли ее сохранять.
АзбукаРодов советуют: Подписывайтесь на наш канал
Мутация генов гемостаза: проявления и последствия

Гемостаз – система организма, которая отвечает за нормальную остановку кровотечений и свертываемость крови. Функционирование гемостаза зависит от состояния стенок сосудов, от количества тромбоцитов в крови и некоторых других факторов.
Различные мутации генов гемостаза могут привести к патологиям развития плода, связанным с нарушением свертываемости крови и не только. Они являются причиной хронического не вынашивания беременности, выкидышей на поздних сроках и других негативных последствий, поэтому важно пройти своевременное обследование.
В каких случаях необходимо обследование на мутации генов гемостаза?
Мутация генов гемостаза
Мутации (полиморфизм) генов – достаточно распространенное явление, поэтому анализы желательно сдавать в нескольких случаях:
- Если женщина подбирает оптимальный метод гормональной контрацепции или проходит заместительную гормональную терапию. Проверка позволит выбрать безопасный метод и не повредить способности к зачатию в дальнейшем.
- Если женщина обращается к врачу по поводу бесплодия или постоянного не вынашивания беременности. О мутациях генов гемостаза могут свидетельствовать многократные неудачные попытки ЭКО, поздние токсикозы, задержки развития плода, токсикоз на поздних сроках и т. д. Даже одного из этих признаков достаточно для того, чтобы было назначено обследование.
- Если имелись случаи тромбозов при возрасте до 50 лет. Особенно это касается курящих мужчин и лиц, у близких родственников которых наблюдались случаи тромбозов глубоких вен инфаркты миокарда и инсульты.
Сдать анализы желательно перед плановыми хирургическими операциями: трансплантацией, эндопротеззированием и т. д.
Нарушение свертываемости крови в процессе серьезного вмешательства может привести к грозным осложнениям и гибели больного.
Если у молодого человека присутствует нарушение слуха, установить причину которого не удается. Это основные случаи, при которых требуется провериться на наличие нарушений в системе гемостаза.
Различные мутации могут оставаться незамеченными в течение многих лет, так как они протекают совершенно бессимптомно и могут возникать внезапно. Однако в критический для организма момент, например, во время беременности или при хирургической операции может обнаружиться нарушение свертываемости крови, способное привести к гибели плода и другим серьезным последствиям.
Причины возникновения мутаций гемостаза
Мутации генов гемостаза могут быть врожденными – они передаются поколениями по нисходящей линии. Из-за этого обязательно нужно проходить проверку, если тромбозы и несвертываемость крови встречались у близких родственников. Однако есть и приобретенные мутации, которые могут возникать под воздействием различных факторов.
Одной из причин является антифосфолипидный синдром – это аутоиммунное заболевание, при котором в организме начинают вырабатываться антитела к собственным фосфолипидам.
Аутоимунные проблемы возникают нечасто, однако мутации гемостаза могут возникать и по другим причинам:
- Постоянные стрессы. Они снижают сопротивляемость организма инфекциям, кроме того, при постоянном перенапряжении нарушаются различные функции организма.
- Онкологические или эндокринные заболевания. Отчасти они могут быть связаны с экологической обстановкой: доказано, что в определенных районах раковые опухоли и различные мутации генов встречаются чаще из-за загрязнения природы вследствие деятельности человека.
- Употребление лекарственных препаратов, в том числе гормональных. Обследование желательно проводить перед приемом гормональных контрацептивов, чтобы избежать их негативного влияния на организм.
из которого можно узнать что такое гемостаз.
Причин возникновения мутаций достаточно много: в дополнительной группе риска окажутся люди с выраженным ожирением, к их появлению могут привести некоторые виды травм.
До сих пор точно неизвестно, по какому именно принципу возникают мутации того или иного гена, однако сейчас медицина научилась сводить к минимуму последствия такого полиморфизма.
Важно при появлении подозрений сдать анализы, причем сделать это рекомендуется еще на этапе планирования беременности.
Основные гены гемостаза, в которых возникают мутации
Виды генов в которых может возникнуть мутация
При обращении в клинику пациенту предлагают пройти комплексное обследование. Анализ на полиморфизм проводится в отношении следующих генов:
- G20210A – ген протромбинов. Его мутации проявляются врожденными тромбофилиями, возможны тромбозы различных сосудов, значительно увеличивается риск инфарктов и инсультов. Прием контрацептивных препаратов в несколько раз повышает риск образования тромбов. У беременных мутация этого гена проявляется не вынашиванием плода, отслойкой плаценты, задержками развития плода.
- G1691A –мутация Лейдена, проявляющаяся изменениями гена 5 фактора. Симптомы можно назвать аналогичными, для этого вида мутаций характерна гибель плода в течение второго и третьего триместра.
- FGB G455A – мутации генов фибриногена. Их проявлениями могут стать тромбозы глубоких вен и тромбоэмболии, не вынашивание плода, привычные аборты на ранних и поздних сроках.
- MTRR и MTHFR – гены метаболизма фолиевой кислоты. Их мутации могут привести к порокам развития нервной системы у плода, сердца, сосудов, урогенитального аппарата. Обследование, выявляющее такие мутации, рекомендуется пройти всем женщинам, планирующим беременность и находящимся в группе риска.
- MTHFR C677T – еще один ген метаболизма фолиевой кислоты. Если в нем возникают мутации, нарушается работа фермента метилентетрагидрофолатредуктаза, преобразующего гомоцистеин в метионин. Если наблюдается этот процесс, почти в 1,5-2 раза повышается риск развития атеросклероза, увеличивается вероятность рождения плода с отклонениями нервной системы. У детей может наблюдаться анэнцефалия, глубокая умственная отсталость и другие варианты поражения.
- GPIa C807T –ген гликопротеина. Мутации проявляются тромбозами и тромбоэмболиями, повышается риск инфарктов миокарда и инсультов в молодом возрасте. Мутационные изменения передаются по наследству, поэтому такой фактор нужно обязательно учитывать при планировании беременности, особенно если уже имели место выкидыши.
- PAI-1 4G/5G – ген, отвечающий за ингибитор активатора плазминогена. Мутации становятся причиной выкидышей на ранних и поздних сроках, гестозов, отслойки плаценты и других негативных последствий. Своевременное выявление мутаций позволяет снижать риск их проявления в период беременности и во время родов.
Есть и еще некоторые гены, состояние которых подлежит анализу в ходе исследования. В зависимости от его результатов пара сможет принять решение о том, стоит ли планировать беременность, которая с высокой долей вероятности будет проходить с опасными осложнениями. Такое решение дается нелегко, но нужно трезво оценить степень риска и принять обдуманное взвешенное решение.
Как проводится исследование генов гемостаза?
Сдача анализа на гемостаз
Работоспособность системы гемостаза может анализироваться несколькими способами: в качестве анализного материала может использоваться капиллярная и венозная кровь, сдавать образцы необходимо натощак. Желательно заранее узнать график работы лаборатории и воздержаться накануне от употребления острой или соленой пищи, чтобы не исказились результаты анализов.
Сейчас есть еще один способ получения материала для анализа: в некоторых клиниках используется защечный мазок, позволяющий получить клетки эпителия обратной стороны щеки.
Такой метод является совершенно безболезненным и очень быстрым, это возможность провести обследование без дискомфорта даже для людей, боящихся уколов.
После проведения лабораторных исследований назначается консультация специалиста-гематолога, который подробно объяснит полученный результат.
Анализ проводится методом ПЦР (полимеразной цепной реакции), результат определяется с помощью контрольных образцов.
При проведении лабораторных исследований учитывается тот факт, что во время беременности всегда незначительно повышается уровень свертываемости крови, и это не является патологией. Однако наличие мутаций усиливает этот процесс, и начавшиеся тромбозы способны причинить большой вред организму матери и ребенка.
Чтобы проверить, передается ли мутация по наследству, рекомендуется сдать генетический анализ. Это недешевая процедура, дающая возможность определить вероятность дальнейших отклонений в системе гемостаза у потомков.
Этот вид анализов обязательно назначается людям, в роду которых уже имелись случаи тромбоза.
Бить тревогу нужно обязательно: не выявленная вовремя мутация способна привести к гибели плода или тяжелым порокам в его физическом и умственном развитии.
Возможна ли коррекция нарушений?
Возможно ли успешное завершение беременности и нормальное развитие плода, если были выявлены какие-либо мутации генов гемостаза? Да, современные методы медицины помогают бороться с повышенной свертываемостью крови и предотвращают плацентарную недостаточность пороки развития плода. В этом случае назначается фолиевая кислота, препятствующая образованию тромбов, специальные поливитамины и различные иные препараты. Если точно соблюдать врачебные рекомендации, шанс выносить здорового ребенка и успешно родить без осложнений повышается до 95%.
Выявление нарушений в работе системы гемостаза не является приговором для больного. Есть специальные лекарственные средства, способные предупредить тромбозы и минимизировать последствия хромосомных отклонений.
Даже если у женщины несколько раз не получалось доносить беременность, после начала правильного лечения, можно значительно увеличить шансы на успех.
Успехи лабораторных методов исследования позволили получать максимально точную информацию о правильности набора хромосом и возможных отклонениях. Сейчас медицина позволяет «вести» весь процесс беременности, своевременно корректируя любые отклонения. Если вовремя обратиться к специалистам и воспользоваться профессиональной помощью, риск пороков развития можно свести к минимуму.
Генетические анализы при потерях беременности

Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.
Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Генетические факторы риска невынашивания и осложнений беременности. Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)


array(19) { [«catalog_code»]=> string(6) «180036» [«name»]=> string(417) «Генетические факторы риска невынашивания и осложнений беременности.
Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3547» [«url»]=> string(78) «geneticheskije-faktory-riska-nevynashivanija-i-oslozhnenij-beremennosti-180036» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи, можно пить воду без газа.
» [«opisanie»]=> string(16861) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Невынашивание беременности — одна из самых актуальных проблем современного акушерства. Частота невынашивания беременности составляет от 10 до 25 % всех беременностей.
Одной из ведущих причин невынашивания беременности ранних сроков являются различные генетические факторы, причем помимо хромосомных перестроек невынашивание беременности может возникать как результат экспрессии функционально ослабленных вариантов (полиморфизмов) вышеперечисленных генов на фоне неблагоприятных внешних и внутренних факторов.
Выявление генетических полиморфизмов при планировании беременности позволяет минимизировать возможные опасные последствия, обусловленные индивидуальными генетическими особенностями женщины.
На сегодняшний день используется целая группа лекарственных препаратов еще на этапе планирования беременности (препараты, препятствующие агрегации тромбоцитов, антикоагулянты, полиненасыщенные жирные кислоты, антиоксиданты, фолиевая кислота и витаминно-минеральные комплексы), вероятность благополучного исхода беременности высока и при правильном и своевременном лечении достигает 95%.
В данной панели исследуются различные факторы, обусловливающие генетическую предрасположенность к невынашиванию и осложнениям беременности.
Ген F2 кодирует протромбин (коагуляционный фактор II), ген F5 кодирует коагуляционный фактор V – оба белка являются ключевыми компонентами свертывающей системы крови.
Вариации в данных генах обусловливают генетическую предрасположенность к повышенному тромбообразованию.
При наличии фактора риска в гене F2 повышен риск развития таких осложнений как невынашивание беременности, фетоплацентарная недостаточность, внутриутробная гибель плода, токсикоз, задержка развития плода и отслойка плаценты.
Наиболее опасным периодом в плане развития тромбозов глубоких вен во время беременности является конец второго — третий триместр и ранний послеродовый период. При наличии изменений в гене F5 повышен риск развития преэклампсии, отслойки нормально расположенной плаценты, ранней потери беременности, привычного невынашивания.
Определенную роль в невынашивании беременности могут играть гены, принимающие участие в метаболизме фолиевой кислоты и витамина В12. Высокие концентрации активной формы фолиевой кислоты необходимы для превращения гомоцистеина в метионин.
Основными генами, продукты которых контролируют превращение фолиевой кислоты в метаболически активные формы и регулируют обмен гомоцистеина, являются MTHFR(метилентетрагидрофолатредуктаза), MTRR (метионинсинтетазредуктаза), MTR (метионинредуктаза).
Полиморфизмы в этих генах связаны со снижением активности соответствующих ферментов и могут приводить к накоплению гомоцистеина.
Повышенный уровень гомоцистеина при беременности может приводить к нарушениям фетоплацентарного кровообращения, хронической гипоксии плода, задержке внутриутробного развития, преэклампсии, отслойки плаценты, развитию врожденного порока Spina bifida. При дополнительном действии других неблагоприятных факторов возможно самопроизвольное прерывание беременности на ранних сроках, в ряде случаев — привычное невынашивание беременности.
Ген FGB кодирует фибриноген — белок, предшественник фибрина, присутствующий в плазме крови.
Под влиянием фермента тромбина из фибриногена образуется нерастворимый белок фибрин на заключительном этапе свертывания крови, что образует основу фибринового тромба.
Исследуемая вариация в гене FGB ассоциирована с повышением уровня фибриногена плазмы крови, и, как следствие, повышением риска развития преэклампсии, отслойки нормально расположенной плаценты и развития акушерских осложнений.
Изменение гена SERPINE1 приводит к повышению концентрации белка ингибитора активатора плазминогена и обусловливает повышенную склонность к тромбозу.
Наличие фактора риска связано с повышенным риском отслойки хориона и плаценты в ранние сроки беременности и, по некоторым литературным данным, с повышенным риском ранней потери беременности, особенно в сочетании с дополнительными отягощающими факторами.
Ген ESR1 кодирует рецептор эстрогена альфа. Гормон участвует в регуляции полового развития, гаметогенеза, роста и поддержания скелета, функционировании сердечно-сосудистой и нервной систем.
Изменения гена приводят к снижению выработки эстрогенового рецептора, вызывая риск невынашивания беременности, акушерских осложнений, а полиморфизм T>C (PvuII), кроме того, дает неблагоприятный прогноз для осуществления ЭКО.
Полиморфизм в гене AGT, кодирующем ангиотензиноген, приводит к повышению концентрации ангиотензиногена в крови, повышая риск развития преэклампсии во время беременности. У женщин — носителей аллеля риска С повышен риск развития инфаркта миокарда и других сердечно — сосудистых событий на фоне гормоно-заместительной терапии (ГЗТ).
Гестационный диабет – повышенное содержание глюкозы в крови, возникающее во время беременности. При возникновении гестационного сахарного диабета на начальных сроках беременности значительно возрастает риск самопроизвольного аборта, врожденных пороков развития сердца и мозговых структур плода.
На поздних сроках (2-3й триместры), гестационный диабет приводит к чрезмерному росту плода (макросомии) и гиперинсулинемии, а после рождения может проявиться заболеванием внутренних органов плода (диабетической фетопатией). Ген TCF7L2 кодирует фактор, регулирующий рост, деление и развитие клеток поджелудочной железы.
Исследуемый генетический вариант ассоциирован с повышенным риском развития гестационного диабета (диабета беременных).
Показания к исследованию:
- Всем женщинам при плановой подготовке к беременности;
- При наличии в анамнезе двух и более прерываний беременности на ранних сроках, тяжёлых осложнений беременности (гестоз, задержка развития плода, внутриутробная гибель плода), неудачных попытках ЭКО;
- При назначении оральных гормональных контрацептивов, заместительной гормональной терапии (при выявлении генетической предрасположенности к тромбозам назначение данной категории препаратов противопоказано!);
- При подготовке к ЭКО;
- При низком уровне половых гормонов (эстрогенов).
Интерпретация результатов:
Пример результата исследования. Генетические факторы риска невынашивания и осложнений беременности
| Полиморфизм в гене F2 (протромбин, 20210 G>A), rs1799963 | GG |
| Полиморфизм в гене F5 (коагуляционный фактор V, мутация Лейдена, R534Q G>A), rs6025 | GG |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, E429A, A>C) rs1801131 | AA |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133 | TT |
| Полиморфизм в гене FGB (фибриноген, 455 G>A) rs1800790 | AA |
| Полиморфизм в гене SERPINE1 (ингибитор активатора плазминогена 1, –675 5G>4G, rs1799768) | 5G/5G |
| Полиморфизм в гене MTR (Метионинсинтаза, D919G, A>G) rs1805087 | AA |
| Полиморфизм в гене MTRR (Метионинсинтазаредуктаза, I22M, A>G) rs1801394 | AA |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, T>C (PvuII)), rs2234693 | TС |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, A>G (XbaI)) rs9340799 | AG |
| Полиморфизм в гене AGT (Ангиотензиноген, M268T, T>C), rs699 | CC |
| Полиморфизм в гене TCF7L2 (Фактор транскрипции 7, IVS3 C>T) rs7903146 | CC |
Анализ на генетику при беременности — что показывает и зачем нужен

Во время генетического анализа специалисты-генетики изучают гены, которые отвечают за передачу наследственных данных от родителей ребенку. Они рассчитывают вероятный результат зачатия, определяют доминантные признаки плода, а также возможные заболевания с пороками развития.
Идеальным вариантом считается обращение к генетику на этапе планирования беременности.
Что показывает генетический анализ при беременности
Анализ на генетику при беременности проводится, чтобы вы могли узнать информацию:
- обладают ли будущие родители генетической совместимостью;
- риск наследственной предрасположенности малыша к определенным болезням;
- имеются ли у матери и ребенка инфекционные возбудители;
- генетический паспорт лица, где находится комбинированный анализ ДНК, отражающий сведения о неповторимости конкретного лица.
Перечисленные данные помогут предупредить нарушения со здоровьем малыша.
Отдельное внимание следует уделить генетическому обследованию при замершей беременности. Иногда именно из-за врожденной тромбофилии случается многократное невынашивание ребенка.
Повторные случаи неразвивающегося плодного яйца у женщины – повод отправить материал на определение кариотипа с хромосомным набором эмбриона.
Специалист может исследовать содержание у беременной ИЛ-4: при замирании плода уровень цитокинов снижен.
Зачем и на каком сроке сдавать анализ
После возникновения хромосомной мутации изменяется структура молекулы ДНК, формируется плод с тяжелейшими аномалиями. Чтобы предотвратить патологию, врачи рекомендуют планировать беременность с проведением генетических тестов, демонстрирующих почти 100% точность подтверждения нарушений развития плода.
Для оценки внутриутробного развития специалисты проводят ультразвуковую диагностику и биохимический тест. Они не представляют никакой угрозы для здоровья или жизни малыша.
Первое УЗИ беременная проходит на сроке 10-14 недель, второе – 20-24 недели. Врач обнаруживает даже незначительные дефекты крохи.
На 10-13 и 16-20 недель будущие мамы сдают генетическую двойку: так называется анализ крови на ХГЧ и РАРР-А.
Если после применения перечисленных методов специалист выявляет патологию развития, назначаются инвазивные тесты.
Они выполняются в следующие периоды гестации:
- Биопсия хориона: на сроке 10-12 недель.
- Амниоцентез: 15-18 недель.
- Плацентоцентез: 16-20 недель.
- Кордоцентез: по завершении 18 недель.
Показания к проведению анализа
Выполнение генетического теста обязательно, если беременная включается в группу риска:
- будущая мама превышает 35-летний возраст;
- у будущей мамы уже рождались дети с врожденными аномалиями или отклонениями;
- в предыдущей беременности женщина перенесла опасные инфекции;
- наличие продолжительного времени алкогольной или наркотической зависимости перед наступлением оплодотворения;
- наличие случаев самопроизвольного выкидыша или мертворождения.
Группа повышенного риска
Существует определенная категория дам, которым показана обязательная консультация генетика:
- Будущая мама не достигла 18 лет или возраст превысил 35 лет.
- Наличие болезней наследственного характера.
- Женщины, родившие ребенка с аномалиями развития.
- Имеющие в прошлом или нынешнее время любой вид зависимости – алкогольной, наркотический, табачной.
- Пары, страдающие опасными инфекциями – ВИЧ, гепатит, беременные перенесшие краснуху, ветрянку, герпес на начальных сроках гестации.
- Будущая мама, которая принимала лекарственные средства, нежелательные для применения во время вынашивания ребенка.
- Получившие дозу облучения в начале гестации из-за прохождения флюорографии или рентгенологического обследования.
- Занимавшиеся в молодые годы экстремальным спортом женщины.
- Будущие мамы, принявшие высокую дозу УФ-облучения.
Иногда женщина не знает о произошедшем зачатии, подвергаясь действию неблагоприятных факторов. Поэтому риск попадания в группу риска появляется у многих беременных.
Подготовительные меры
Как подготовиться? Перед сдачей крови постарайтесь с утра не есть или пройдите тест по прошествии 5 часов после еды.
Для подготовки к УЗИ абдоминальным методом за 30 минут до исследования выпейте пол-литра обычной воды, чтобы наполнить мочевой пузырь. За 1-2 дня придерживайтесь диеты.
Откажитесь от употребления продуктов, вызывающих брожение: капуста, виноград, черный хлеб, газированные напитки.
Если потребуется провести вагинальное обследование, заранее примите душ, а перед процедурой опорожните мочевой пузырь.
Как делают генетический анализ — методы проведения исследований
Генетик подробно изучает родословную будущих родителей, оценивает риск наследственных заболеваний. Специалист учитывает профессиональную сферу, экологические условия, влияние лекарственных средств, принимаемых незадолго до визита к доктору.
Врач проводит исследование кариотипа, который необходим для будущей мамы с отягощенным анамнезом. Оно дает возможность проанализировать качественный и количественный хромосомный состав женщины. Если родители – близкие кровные родственники или случалось невынашивание беременности, необходимо провести HLA-типирование.
Генетик проводит неинвазивные методы диагностики врожденных аномалий развития плода – УЗИ и тесты на биохимические маркеры.
К последним относятся:
- определение содержания ХГЧ;
- анализ крови на РАРР-А.
Американской компанией был запатентован еще 1 тест. На 9 неделе будущая мама сдает венозную кровь, где содержится наследственная информация – ДНК ребенка. Специалисты подсчитывают число хромосом, а при наличии патологии выявляются ряд синдромов – Дауна, Эдварса, Патау, Тернера, Ангельмана.
Если неинвазивные исследования обнаруживают аномалии, специалист проводит инвазивное обследование. С их помощью осуществляют забор материала, определяют с высокой точностью кариотип малыша для исключения наследственной патологии – синдрома Дауна, Эдварда.
К таким методам относятся:
- Биопсия хориона. Врач проводит прокол передней брюшной стенки, а затем берет клетки формирующейся плаценты.
- Амниоцентез. Берут пункцию амниотической жидкости, оценивают ее цвет, прозрачность, клеточный и биохимический состав, объем, уровень гормонов. Процедура считается наиболее безопасной из инвазивных диагностических методов, но требует немало времени для получения заключения. Обследование выявляет аномалии, появившиеся во время беременности, оценивает уровень развития плода.
- Кордоцентез. Исследование заключается в проведении пункции пуповины с забором крови ребенка. Метод является точным, а результаты становятся известны через несколько дней.
- Плацентоцентез. Осуществляется анализ плацентарных клеток.
В результате проведенных тестов специалист составляет для родителей генетический прогноз. На его основании можно предугадать вероятность появления врожденных патологий у малыша, наследственных заболеваний. Врач разрабатывает рекомендации, помогающие планировать нормальную беременность, а если зачатие уже произошло, определяет, стоит ли ее сохранять.
АзбукаРодов советуют: Подписывайтесь на наш канал
Мутация генов гемостаза: проявления и последствия

Гемостаз – система организма, которая отвечает за нормальную остановку кровотечений и свертываемость крови. Функционирование гемостаза зависит от состояния стенок сосудов, от количества тромбоцитов в крови и некоторых других факторов.
Различные мутации генов гемостаза могут привести к патологиям развития плода, связанным с нарушением свертываемости крови и не только. Они являются причиной хронического не вынашивания беременности, выкидышей на поздних сроках и других негативных последствий, поэтому важно пройти своевременное обследование.
В каких случаях необходимо обследование на мутации генов гемостаза?
Мутация генов гемостаза
Мутации (полиморфизм) генов – достаточно распространенное явление, поэтому анализы желательно сдавать в нескольких случаях:
- Если женщина подбирает оптимальный метод гормональной контрацепции или проходит заместительную гормональную терапию. Проверка позволит выбрать безопасный метод и не повредить способности к зачатию в дальнейшем.
- Если женщина обращается к врачу по поводу бесплодия или постоянного не вынашивания беременности. О мутациях генов гемостаза могут свидетельствовать многократные неудачные попытки ЭКО, поздние токсикозы, задержки развития плода, токсикоз на поздних сроках и т. д. Даже одного из этих признаков достаточно для того, чтобы было назначено обследование.
- Если имелись случаи тромбозов при возрасте до 50 лет. Особенно это касается курящих мужчин и лиц, у близких родственников которых наблюдались случаи тромбозов глубоких вен инфаркты миокарда и инсульты.
Сдать анализы желательно перед плановыми хирургическими операциями: трансплантацией, эндопротеззированием и т. д.
Нарушение свертываемости крови в процессе серьезного вмешательства может привести к грозным осложнениям и гибели больного.
Если у молодого человека присутствует нарушение слуха, установить причину которого не удается. Это основные случаи, при которых требуется провериться на наличие нарушений в системе гемостаза.
Различные мутации могут оставаться незамеченными в течение многих лет, так как они протекают совершенно бессимптомно и могут возникать внезапно. Однако в критический для организма момент, например, во время беременности или при хирургической операции может обнаружиться нарушение свертываемости крови, способное привести к гибели плода и другим серьезным последствиям.
Причины возникновения мутаций гемостаза
Мутации генов гемостаза могут быть врожденными – они передаются поколениями по нисходящей линии. Из-за этого обязательно нужно проходить проверку, если тромбозы и несвертываемость крови встречались у близких родственников. Однако есть и приобретенные мутации, которые могут возникать под воздействием различных факторов.
Одной из причин является антифосфолипидный синдром – это аутоиммунное заболевание, при котором в организме начинают вырабатываться антитела к собственным фосфолипидам.
Аутоимунные проблемы возникают нечасто, однако мутации гемостаза могут возникать и по другим причинам:
- Постоянные стрессы. Они снижают сопротивляемость организма инфекциям, кроме того, при постоянном перенапряжении нарушаются различные функции организма.
- Онкологические или эндокринные заболевания. Отчасти они могут быть связаны с экологической обстановкой: доказано, что в определенных районах раковые опухоли и различные мутации генов встречаются чаще из-за загрязнения природы вследствие деятельности человека.
- Употребление лекарственных препаратов, в том числе гормональных. Обследование желательно проводить перед приемом гормональных контрацептивов, чтобы избежать их негативного влияния на организм.
из которого можно узнать что такое гемостаз.
Причин возникновения мутаций достаточно много: в дополнительной группе риска окажутся люди с выраженным ожирением, к их появлению могут привести некоторые виды травм.
До сих пор точно неизвестно, по какому именно принципу возникают мутации того или иного гена, однако сейчас медицина научилась сводить к минимуму последствия такого полиморфизма.
Важно при появлении подозрений сдать анализы, причем сделать это рекомендуется еще на этапе планирования беременности.
Основные гены гемостаза, в которых возникают мутации
Виды генов в которых может возникнуть мутация
При обращении в клинику пациенту предлагают пройти комплексное обследование. Анализ на полиморфизм проводится в отношении следующих генов:
- G20210A – ген протромбинов. Его мутации проявляются врожденными тромбофилиями, возможны тромбозы различных сосудов, значительно увеличивается риск инфарктов и инсультов. Прием контрацептивных препаратов в несколько раз повышает риск образования тромбов. У беременных мутация этого гена проявляется не вынашиванием плода, отслойкой плаценты, задержками развития плода.
- G1691A –мутация Лейдена, проявляющаяся изменениями гена 5 фактора. Симптомы можно назвать аналогичными, для этого вида мутаций характерна гибель плода в течение второго и третьего триместра.
- FGB G455A – мутации генов фибриногена. Их проявлениями могут стать тромбозы глубоких вен и тромбоэмболии, не вынашивание плода, привычные аборты на ранних и поздних сроках.
- MTRR и MTHFR – гены метаболизма фолиевой кислоты. Их мутации могут привести к порокам развития нервной системы у плода, сердца, сосудов, урогенитального аппарата. Обследование, выявляющее такие мутации, рекомендуется пройти всем женщинам, планирующим беременность и находящимся в группе риска.
- MTHFR C677T – еще один ген метаболизма фолиевой кислоты. Если в нем возникают мутации, нарушается работа фермента метилентетрагидрофолатредуктаза, преобразующего гомоцистеин в метионин. Если наблюдается этот процесс, почти в 1,5-2 раза повышается риск развития атеросклероза, увеличивается вероятность рождения плода с отклонениями нервной системы. У детей может наблюдаться анэнцефалия, глубокая умственная отсталость и другие варианты поражения.
- GPIa C807T –ген гликопротеина. Мутации проявляются тромбозами и тромбоэмболиями, повышается риск инфарктов миокарда и инсультов в молодом возрасте. Мутационные изменения передаются по наследству, поэтому такой фактор нужно обязательно учитывать при планировании беременности, особенно если уже имели место выкидыши.
- PAI-1 4G/5G – ген, отвечающий за ингибитор активатора плазминогена. Мутации становятся причиной выкидышей на ранних и поздних сроках, гестозов, отслойки плаценты и других негативных последствий. Своевременное выявление мутаций позволяет снижать риск их проявления в период беременности и во время родов.
Есть и еще некоторые гены, состояние которых подлежит анализу в ходе исследования. В зависимости от его результатов пара сможет принять решение о том, стоит ли планировать беременность, которая с высокой долей вероятности будет проходить с опасными осложнениями. Такое решение дается нелегко, но нужно трезво оценить степень риска и принять обдуманное взвешенное решение.
Как проводится исследование генов гемостаза?
Сдача анализа на гемостаз
Работоспособность системы гемостаза может анализироваться несколькими способами: в качестве анализного материала может использоваться капиллярная и венозная кровь, сдавать образцы необходимо натощак. Желательно заранее узнать график работы лаборатории и воздержаться накануне от употребления острой или соленой пищи, чтобы не исказились результаты анализов.
Сейчас есть еще один способ получения материала для анализа: в некоторых клиниках используется защечный мазок, позволяющий получить клетки эпителия обратной стороны щеки.
Такой метод является совершенно безболезненным и очень быстрым, это возможность провести обследование без дискомфорта даже для людей, боящихся уколов.
После проведения лабораторных исследований назначается консультация специалиста-гематолога, который подробно объяснит полученный результат.
Анализ проводится методом ПЦР (полимеразной цепной реакции), результат определяется с помощью контрольных образцов.
При проведении лабораторных исследований учитывается тот факт, что во время беременности всегда незначительно повышается уровень свертываемости крови, и это не является патологией. Однако наличие мутаций усиливает этот процесс, и начавшиеся тромбозы способны причинить большой вред организму матери и ребенка.
Чтобы проверить, передается ли мутация по наследству, рекомендуется сдать генетический анализ. Это недешевая процедура, дающая возможность определить вероятность дальнейших отклонений в системе гемостаза у потомков.
Этот вид анализов обязательно назначается людям, в роду которых уже имелись случаи тромбоза.
Бить тревогу нужно обязательно: не выявленная вовремя мутация способна привести к гибели плода или тяжелым порокам в его физическом и умственном развитии.
Возможна ли коррекция нарушений?
Возможно ли успешное завершение беременности и нормальное развитие плода, если были выявлены какие-либо мутации генов гемостаза? Да, современные методы медицины помогают бороться с повышенной свертываемостью крови и предотвращают плацентарную недостаточность пороки развития плода. В этом случае назначается фолиевая кислота, препятствующая образованию тромбов, специальные поливитамины и различные иные препараты. Если точно соблюдать врачебные рекомендации, шанс выносить здорового ребенка и успешно родить без осложнений повышается до 95%.
Выявление нарушений в работе системы гемостаза не является приговором для больного. Есть специальные лекарственные средства, способные предупредить тромбозы и минимизировать последствия хромосомных отклонений.
Даже если у женщины несколько раз не получалось доносить беременность, после начала правильного лечения, можно значительно увеличить шансы на успех.
Успехи лабораторных методов исследования позволили получать максимально точную информацию о правильности набора хромосом и возможных отклонениях. Сейчас медицина позволяет «вести» весь процесс беременности, своевременно корректируя любые отклонения. Если вовремя обратиться к специалистам и воспользоваться профессиональной помощью, риск пороков развития можно свести к минимуму.
Генетические анализы при потерях беременности

Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.
Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
Но достаточно мифов. Дальше — только факты:
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
И теперь пара слов о лечении:
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Генетические факторы риска невынашивания и осложнений беременности. Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)


array(19) { [«catalog_code»]=> string(6) «180036» [«name»]=> string(417) «Генетические факторы риска невынашивания и осложнений беременности.
Исследование полиморфизмов в генах: F2 (20210 G>A), F5 R534Q G>A), MTHFR (E429A, A>C), MTHFR (A222V, C>T), FGB (455 G>A), SERPINE1 (–675 5G>4G), MTR (D919G, A>G), MTRR (I22M, A>G), ESR1 (T>C (PvuII)), ESR1 (A>G (XbaI)), AGT (M268T, T>C), TCF7L2 (IVS3, C>T)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3547» [«url»]=> string(78) «geneticheskije-faktory-riska-nevynashivanija-i-oslozhnenij-beremennosti-180036» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи, можно пить воду без газа.
» [«opisanie»]=> string(16861) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Невынашивание беременности — одна из самых актуальных проблем современного акушерства. Частота невынашивания беременности составляет от 10 до 25 % всех беременностей.
Одной из ведущих причин невынашивания беременности ранних сроков являются различные генетические факторы, причем помимо хромосомных перестроек невынашивание беременности может возникать как результат экспрессии функционально ослабленных вариантов (полиморфизмов) вышеперечисленных генов на фоне неблагоприятных внешних и внутренних факторов.
Выявление генетических полиморфизмов при планировании беременности позволяет минимизировать возможные опасные последствия, обусловленные индивидуальными генетическими особенностями женщины.
На сегодняшний день используется целая группа лекарственных препаратов еще на этапе планирования беременности (препараты, препятствующие агрегации тромбоцитов, антикоагулянты, полиненасыщенные жирные кислоты, антиоксиданты, фолиевая кислота и витаминно-минеральные комплексы), вероятность благополучного исхода беременности высока и при правильном и своевременном лечении достигает 95%.
В данной панели исследуются различные факторы, обусловливающие генетическую предрасположенность к невынашиванию и осложнениям беременности.
Ген F2 кодирует протромбин (коагуляционный фактор II), ген F5 кодирует коагуляционный фактор V – оба белка являются ключевыми компонентами свертывающей системы крови.
Вариации в данных генах обусловливают генетическую предрасположенность к повышенному тромбообразованию.
При наличии фактора риска в гене F2 повышен риск развития таких осложнений как невынашивание беременности, фетоплацентарная недостаточность, внутриутробная гибель плода, токсикоз, задержка развития плода и отслойка плаценты.
Наиболее опасным периодом в плане развития тромбозов глубоких вен во время беременности является конец второго — третий триместр и ранний послеродовый период. При наличии изменений в гене F5 повышен риск развития преэклампсии, отслойки нормально расположенной плаценты, ранней потери беременности, привычного невынашивания.
Определенную роль в невынашивании беременности могут играть гены, принимающие участие в метаболизме фолиевой кислоты и витамина В12. Высокие концентрации активной формы фолиевой кислоты необходимы для превращения гомоцистеина в метионин.
Основными генами, продукты которых контролируют превращение фолиевой кислоты в метаболически активные формы и регулируют обмен гомоцистеина, являются MTHFR(метилентетрагидрофолатредуктаза), MTRR (метионинсинтетазредуктаза), MTR (метионинредуктаза).
Полиморфизмы в этих генах связаны со снижением активности соответствующих ферментов и могут приводить к накоплению гомоцистеина.
Повышенный уровень гомоцистеина при беременности может приводить к нарушениям фетоплацентарного кровообращения, хронической гипоксии плода, задержке внутриутробного развития, преэклампсии, отслойки плаценты, развитию врожденного порока Spina bifida. При дополнительном действии других неблагоприятных факторов возможно самопроизвольное прерывание беременности на ранних сроках, в ряде случаев — привычное невынашивание беременности.
Ген FGB кодирует фибриноген — белок, предшественник фибрина, присутствующий в плазме крови.
Под влиянием фермента тромбина из фибриногена образуется нерастворимый белок фибрин на заключительном этапе свертывания крови, что образует основу фибринового тромба.
Исследуемая вариация в гене FGB ассоциирована с повышением уровня фибриногена плазмы крови, и, как следствие, повышением риска развития преэклампсии, отслойки нормально расположенной плаценты и развития акушерских осложнений.
Изменение гена SERPINE1 приводит к повышению концентрации белка ингибитора активатора плазминогена и обусловливает повышенную склонность к тромбозу.
Наличие фактора риска связано с повышенным риском отслойки хориона и плаценты в ранние сроки беременности и, по некоторым литературным данным, с повышенным риском ранней потери беременности, особенно в сочетании с дополнительными отягощающими факторами.
Ген ESR1 кодирует рецептор эстрогена альфа. Гормон участвует в регуляции полового развития, гаметогенеза, роста и поддержания скелета, функционировании сердечно-сосудистой и нервной систем.
Изменения гена приводят к снижению выработки эстрогенового рецептора, вызывая риск невынашивания беременности, акушерских осложнений, а полиморфизм T>C (PvuII), кроме того, дает неблагоприятный прогноз для осуществления ЭКО.
Полиморфизм в гене AGT, кодирующем ангиотензиноген, приводит к повышению концентрации ангиотензиногена в крови, повышая риск развития преэклампсии во время беременности. У женщин — носителей аллеля риска С повышен риск развития инфаркта миокарда и других сердечно — сосудистых событий на фоне гормоно-заместительной терапии (ГЗТ).
Гестационный диабет – повышенное содержание глюкозы в крови, возникающее во время беременности. При возникновении гестационного сахарного диабета на начальных сроках беременности значительно возрастает риск самопроизвольного аборта, врожденных пороков развития сердца и мозговых структур плода.
На поздних сроках (2-3й триместры), гестационный диабет приводит к чрезмерному росту плода (макросомии) и гиперинсулинемии, а после рождения может проявиться заболеванием внутренних органов плода (диабетической фетопатией). Ген TCF7L2 кодирует фактор, регулирующий рост, деление и развитие клеток поджелудочной железы.
Исследуемый генетический вариант ассоциирован с повышенным риском развития гестационного диабета (диабета беременных).
Показания к исследованию:
- Всем женщинам при плановой подготовке к беременности;
- При наличии в анамнезе двух и более прерываний беременности на ранних сроках, тяжёлых осложнений беременности (гестоз, задержка развития плода, внутриутробная гибель плода), неудачных попытках ЭКО;
- При назначении оральных гормональных контрацептивов, заместительной гормональной терапии (при выявлении генетической предрасположенности к тромбозам назначение данной категории препаратов противопоказано!);
- При подготовке к ЭКО;
- При низком уровне половых гормонов (эстрогенов).
Интерпретация результатов:
Пример результата исследования. Генетические факторы риска невынашивания и осложнений беременности
| Полиморфизм в гене F2 (протромбин, 20210 G>A), rs1799963 | GG |
| Полиморфизм в гене F5 (коагуляционный фактор V, мутация Лейдена, R534Q G>A), rs6025 | GG |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, E429A, A>C) rs1801131 | AA |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133 | TT |
| Полиморфизм в гене FGB (фибриноген, 455 G>A) rs1800790 | AA |
| Полиморфизм в гене SERPINE1 (ингибитор активатора плазминогена 1, –675 5G>4G, rs1799768) | 5G/5G |
| Полиморфизм в гене MTR (Метионинсинтаза, D919G, A>G) rs1805087 | AA |
| Полиморфизм в гене MTRR (Метионинсинтазаредуктаза, I22M, A>G) rs1801394 | AA |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, T>C (PvuII)), rs2234693 | TС |
| Полиморфизм в гене ESR1 (Эстрогеновый рецептор, A>G (XbaI)) rs9340799 | AG |
| Полиморфизм в гене AGT (Ангиотензиноген, M268T, T>C), rs699 | CC |
| Полиморфизм в гене TCF7L2 (Фактор транскрипции 7, IVS3 C>T) rs7903146 | CC |
Анализ на генетику при беременности — что показывает и зачем нужен

Во время генетического анализа специалисты-генетики изучают гены, которые отвечают за передачу наследственных данных от родителей ребенку. Они рассчитывают вероятный результат зачатия, определяют доминантные признаки плода, а также возможные заболевания с пороками развития.
Идеальным вариантом считается обращение к генетику на этапе планирования беременности.
Что показывает генетический анализ при беременности
Анализ на генетику при беременности проводится, чтобы вы могли узнать информацию:
- обладают ли будущие родители генетической совместимостью;
- риск наследственной предрасположенности малыша к определенным болезням;
- имеются ли у матери и ребенка инфекционные возбудители;
- генетический паспорт лица, где находится комбинированный анализ ДНК, отражающий сведения о неповторимости конкретного лица.
Перечисленные данные помогут предупредить нарушения со здоровьем малыша.
Отдельное внимание следует уделить генетическому обследованию при замершей беременности. Иногда именно из-за врожденной тромбофилии случается многократное невынашивание ребенка.
Повторные случаи неразвивающегося плодного яйца у женщины – повод отправить материал на определение кариотипа с хромосомным набором эмбриона.
Специалист может исследовать содержание у беременной ИЛ-4: при замирании плода уровень цитокинов снижен.
Зачем и на каком сроке сдавать анализ
После возникновения хромосомной мутации изменяется структура молекулы ДНК, формируется плод с тяжелейшими аномалиями. Чтобы предотвратить патологию, врачи рекомендуют планировать беременность с проведением генетических тестов, демонстрирующих почти 100% точность подтверждения нарушений развития плода.
Для оценки внутриутробного развития специалисты проводят ультразвуковую диагностику и биохимический тест. Они не представляют никакой угрозы для здоровья или жизни малыша.
Первое УЗИ беременная проходит на сроке 10-14 недель, второе – 20-24 недели. Врач обнаруживает даже незначительные дефекты крохи.
На 10-13 и 16-20 недель будущие мамы сдают генетическую двойку: так называется анализ крови на ХГЧ и РАРР-А.
Если после применения перечисленных методов специалист выявляет патологию развития, назначаются инвазивные тесты.
Они выполняются в следующие периоды гестации:
- Биопсия хориона: на сроке 10-12 недель.
- Амниоцентез: 15-18 недель.
- Плацентоцентез: 16-20 недель.
- Кордоцентез: по завершении 18 недель.
Показания к проведению анализа
Выполнение генетического теста обязательно, если беременная включается в группу риска:
- будущая мама превышает 35-летний возраст;
- у будущей мамы уже рождались дети с врожденными аномалиями или отклонениями;
- в предыдущей беременности женщина перенесла опасные инфекции;
- наличие продолжительного времени алкогольной или наркотической зависимости перед наступлением оплодотворения;
- наличие случаев самопроизвольного выкидыша или мертворождения.
Группа повышенного риска
Существует определенная категория дам, которым показана обязательная консультация генетика:
- Будущая мама не достигла 18 лет или возраст превысил 35 лет.
- Наличие болезней наследственного характера.
- Женщины, родившие ребенка с аномалиями развития.
- Имеющие в прошлом или нынешнее время любой вид зависимости – алкогольной, наркотический, табачной.
- Пары, страдающие опасными инфекциями – ВИЧ, гепатит, беременные перенесшие краснуху, ветрянку, герпес на начальных сроках гестации.
- Будущая мама, которая принимала лекарственные средства, нежелательные для применения во время вынашивания ребенка.
- Получившие дозу облучения в начале гестации из-за прохождения флюорографии или рентгенологического обследования.
- Занимавшиеся в молодые годы экстремальным спортом женщины.
- Будущие мамы, принявшие высокую дозу УФ-облучения.
Иногда женщина не знает о произошедшем зачатии, подвергаясь действию неблагоприятных факторов. Поэтому риск попадания в группу риска появляется у многих беременных.
Подготовительные меры
Как подготовиться? Перед сдачей крови постарайтесь с утра не есть или пройдите тест по прошествии 5 часов после еды.
Для подготовки к УЗИ абдоминальным методом за 30 минут до исследования выпейте пол-литра обычной воды, чтобы наполнить мочевой пузырь. За 1-2 дня придерживайтесь диеты.
Откажитесь от употребления продуктов, вызывающих брожение: капуста, виноград, черный хлеб, газированные напитки.
Если потребуется провести вагинальное обследование, заранее примите душ, а перед процедурой опорожните мочевой пузырь.
Как делают генетический анализ — методы проведения исследований
Генетик подробно изучает родословную будущих родителей, оценивает риск наследственных заболеваний. Специалист учитывает профессиональную сферу, экологические условия, влияние лекарственных средств, принимаемых незадолго до визита к доктору.
Врач проводит исследование кариотипа, который необходим для будущей мамы с отягощенным анамнезом. Оно дает возможность проанализировать качественный и количественный хромосомный состав женщины. Если родители – близкие кровные родственники или случалось невынашивание беременности, необходимо провести HLA-типирование.
Генетик проводит неинвазивные методы диагностики врожденных аномалий развития плода – УЗИ и тесты на биохимические маркеры.
К последним относятся:
- определение содержания ХГЧ;
- анализ крови на РАРР-А.
Американской компанией был запатентован еще 1 тест. На 9 неделе будущая мама сдает венозную кровь, где содержится наследственная информация – ДНК ребенка. Специалисты подсчитывают число хромосом, а при наличии патологии выявляются ряд синдромов – Дауна, Эдварса, Патау, Тернера, Ангельмана.
Если неинвазивные исследования обнаруживают аномалии, специалист проводит инвазивное обследование. С их помощью осуществляют забор материала, определяют с высокой точностью кариотип малыша для исключения наследственной патологии – синдрома Дауна, Эдварда.
К таким методам относятся:
- Биопсия хориона. Врач проводит прокол передней брюшной стенки, а затем берет клетки формирующейся плаценты.
- Амниоцентез. Берут пункцию амниотической жидкости, оценивают ее цвет, прозрачность, клеточный и биохимический состав, объем, уровень гормонов. Процедура считается наиболее безопасной из инвазивных диагностических методов, но требует немало времени для получения заключения. Обследование выявляет аномалии, появившиеся во время беременности, оценивает уровень развития плода.
- Кордоцентез. Исследование заключается в проведении пункции пуповины с забором крови ребенка. Метод является точным, а результаты становятся известны через несколько дней.
- Плацентоцентез. Осуществляется анализ плацентарных клеток.
В результате проведенных тестов специалист составляет для родителей генетический прогноз. На его основании можно предугадать вероятность появления врожденных патологий у малыша, наследственных заболеваний. Врач разрабатывает рекомендации, помогающие планировать нормальную беременность, а если зачатие уже произошло, определяет, стоит ли ее сохранять.
АзбукаРодов советуют: Подписывайтесь на наш канал
Мутация генов гемостаза: проявления и последствия

Гемостаз – система организма, которая отвечает за нормальную остановку кровотечений и свертываемость крови. Функционирование гемостаза зависит от состояния стенок сосудов, от количества тромбоцитов в крови и некоторых других факторов.
Различные мутации генов гемостаза могут привести к патологиям развития плода, связанным с нарушением свертываемости крови и не только. Они являются причиной хронического не вынашивания беременности, выкидышей на поздних сроках и других негативных последствий, поэтому важно пройти своевременное обследование.
В каких случаях необходимо обследование на мутации генов гемостаза?
Мутация генов гемостаза
Мутации (полиморфизм) генов – достаточно распространенное явление, поэтому анализы желательно сдавать в нескольких случаях:
- Если женщина подбирает оптимальный метод гормональной контрацепции или проходит заместительную гормональную терапию. Проверка позволит выбрать безопасный метод и не повредить способности к зачатию в дальнейшем.
- Если женщина обращается к врачу по поводу бесплодия или постоянного не вынашивания беременности. О мутациях генов гемостаза могут свидетельствовать многократные неудачные попытки ЭКО, поздние токсикозы, задержки развития плода, токсикоз на поздних сроках и т. д. Даже одного из этих признаков достаточно для того, чтобы было назначено обследование.
- Если имелись случаи тромбозов при возрасте до 50 лет. Особенно это касается курящих мужчин и лиц, у близких родственников которых наблюдались случаи тромбозов глубоких вен инфаркты миокарда и инсульты.
Сдать анализы желательно перед плановыми хирургическими операциями: трансплантацией, эндопротеззированием и т. д.
Нарушение свертываемости крови в процессе серьезного вмешательства может привести к грозным осложнениям и гибели больного.
Если у молодого человека присутствует нарушение слуха, установить причину которого не удается. Это основные случаи, при которых требуется провериться на наличие нарушений в системе гемостаза.
Различные мутации могут оставаться незамеченными в течение многих лет, так как они протекают совершенно бессимптомно и могут возникать внезапно. Однако в критический для организма момент, например, во время беременности или при хирургической операции может обнаружиться нарушение свертываемости крови, способное привести к гибели плода и другим серьезным последствиям.
Причины возникновения мутаций гемостаза
Мутации генов гемостаза могут быть врожденными – они передаются поколениями по нисходящей линии. Из-за этого обязательно нужно проходить проверку, если тромбозы и несвертываемость крови встречались у близких родственников. Однако есть и приобретенные мутации, которые могут возникать под воздействием различных факторов.
Одной из причин является антифосфолипидный синдром – это аутоиммунное заболевание, при котором в организме начинают вырабатываться антитела к собственным фосфолипидам.
Аутоимунные проблемы возникают нечасто, однако мутации гемостаза могут возникать и по другим причинам:
- Постоянные стрессы. Они снижают сопротивляемость организма инфекциям, кроме того, при постоянном перенапряжении нарушаются различные функции организма.
- Онкологические или эндокринные заболевания. Отчасти они могут быть связаны с экологической обстановкой: доказано, что в определенных районах раковые опухоли и различные мутации генов встречаются чаще из-за загрязнения природы вследствие деятельности человека.
- Употребление лекарственных препаратов, в том числе гормональных. Обследование желательно проводить перед приемом гормональных контрацептивов, чтобы избежать их негативного влияния на организм.
из которого можно узнать что такое гемостаз.
Причин возникновения мутаций достаточно много: в дополнительной группе риска окажутся люди с выраженным ожирением, к их появлению могут привести некоторые виды травм.
До сих пор точно неизвестно, по какому именно принципу возникают мутации того или иного гена, однако сейчас медицина научилась сводить к минимуму последствия такого полиморфизма.
Важно при появлении подозрений сдать анализы, причем сделать это рекомендуется еще на этапе планирования беременности.
Основные гены гемостаза, в которых возникают мутации
Виды генов в которых может возникнуть мутация
При обращении в клинику пациенту предлагают пройти комплексное обследование. Анализ на полиморфизм проводится в отношении следующих генов:
- G20210A – ген протромбинов. Его мутации проявляются врожденными тромбофилиями, возможны тромбозы различных сосудов, значительно увеличивается риск инфарктов и инсультов. Прием контрацептивных препаратов в несколько раз повышает риск образования тромбов. У беременных мутация этого гена проявляется не вынашиванием плода, отслойкой плаценты, задержками развития плода.
- G1691A –мутация Лейдена, проявляющаяся изменениями гена 5 фактора. Симптомы можно назвать аналогичными, для этого вида мутаций характерна гибель плода в течение второго и третьего триместра.
- FGB G455A – мутации генов фибриногена. Их проявлениями могут стать тромбозы глубоких вен и тромбоэмболии, не вынашивание плода, привычные аборты на ранних и поздних сроках.
- MTRR и MTHFR – гены метаболизма фолиевой кислоты. Их мутации могут привести к порокам развития нервной системы у плода, сердца, сосудов, урогенитального аппарата. Обследование, выявляющее такие мутации, рекомендуется пройти всем женщинам, планирующим беременность и находящимся в группе риска.
- MTHFR C677T – еще один ген метаболизма фолиевой кислоты. Если в нем возникают мутации, нарушается работа фермента метилентетрагидрофолатредуктаза, преобразующего гомоцистеин в метионин. Если наблюдается этот процесс, почти в 1,5-2 раза повышается риск развития атеросклероза, увеличивается вероятность рождения плода с отклонениями нервной системы. У детей может наблюдаться анэнцефалия, глубокая умственная отсталость и другие варианты поражения.
- GPIa C807T –ген гликопротеина. Мутации проявляются тромбозами и тромбоэмболиями, повышается риск инфарктов миокарда и инсультов в молодом возрасте. Мутационные изменения передаются по наследству, поэтому такой фактор нужно обязательно учитывать при планировании беременности, особенно если уже имели место выкидыши.
- PAI-1 4G/5G – ген, отвечающий за ингибитор активатора плазминогена. Мутации становятся причиной выкидышей на ранних и поздних сроках, гестозов, отслойки плаценты и других негативных последствий. Своевременное выявление мутаций позволяет снижать риск их проявления в период беременности и во время родов.
Есть и еще некоторые гены, состояние которых подлежит анализу в ходе исследования. В зависимости от его результатов пара сможет принять решение о том, стоит ли планировать беременность, которая с высокой долей вероятности будет проходить с опасными осложнениями. Такое решение дается нелегко, но нужно трезво оценить степень риска и принять обдуманное взвешенное решение.
Как проводится исследование генов гемостаза?
Сдача анализа на гемостаз
Работоспособность системы гемостаза может анализироваться несколькими способами: в качестве анализного материала может использоваться капиллярная и венозная кровь, сдавать образцы необходимо натощак. Желательно заранее узнать график работы лаборатории и воздержаться накануне от употребления острой или соленой пищи, чтобы не исказились результаты анализов.
Сейчас есть еще один способ получения материала для анализа: в некоторых клиниках используется защечный мазок, позволяющий получить клетки эпителия обратной стороны щеки.
Такой метод является совершенно безболезненным и очень быстрым, это возможность провести обследование без дискомфорта даже для людей, боящихся уколов.
После проведения лабораторных исследований назначается консультация специалиста-гематолога, который подробно объяснит полученный результат.
Анализ проводится методом ПЦР (полимеразной цепной реакции), результат определяется с помощью контрольных образцов.
При проведении лабораторных исследований учитывается тот факт, что во время беременности всегда незначительно повышается уровень свертываемости крови, и это не является патологией. Однако наличие мутаций усиливает этот процесс, и начавшиеся тромбозы способны причинить большой вред организму матери и ребенка.
Чтобы проверить, передается ли мутация по наследству, рекомендуется сдать генетический анализ. Это недешевая процедура, дающая возможность определить вероятность дальнейших отклонений в системе гемостаза у потомков.
Этот вид анализов обязательно назначается людям, в роду которых уже имелись случаи тромбоза.
Бить тревогу нужно обязательно: не выявленная вовремя мутация способна привести к гибели плода или тяжелым порокам в его физическом и умственном развитии.
Возможна ли коррекция нарушений?
Возможно ли успешное завершение беременности и нормальное развитие плода, если были выявлены какие-либо мутации генов гемостаза? Да, современные методы медицины помогают бороться с повышенной свертываемостью крови и предотвращают плацентарную недостаточность пороки развития плода. В этом случае назначается фолиевая кислота, препятствующая образованию тромбов, специальные поливитамины и различные иные препараты. Если точно соблюдать врачебные рекомендации, шанс выносить здорового ребенка и успешно родить без осложнений повышается до 95%.
Выявление нарушений в работе системы гемостаза не является приговором для больного. Есть специальные лекарственные средства, способные предупредить тромбозы и минимизировать последствия хромосомных отклонений.
Даже если у женщины несколько раз не получалось доносить беременность, после начала правильного лечения, можно значительно увеличить шансы на успех.
Успехи лабораторных методов исследования позволили получать максимально точную информацию о правильности набора хромосом и возможных отклонениях. Сейчас медицина позволяет «вести» весь процесс беременности, своевременно корректируя любые отклонения. Если вовремя обратиться к специалистам и воспользоваться профессиональной помощью, риск пороков развития можно свести к минимуму.
Генетические анализы при потерях беременности

Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.
Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
Но достаточно мифов. Дальше — только факты:
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
И теперь пара слов о лечении:
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик





