Фибринолиз: что такое, пути активации, угнетение, у беременных
Фибринолиз — процесс, параллельный тромбообразованию
Фибринолиз — это процесс редукции тромба в организме с участием специальной ферментной системы плазмы крови, кровяных и тканевых лейкоцитов, лекарственных средств.
Фибринолиз — обратный тромбообразованию процесс, он запускается одновременно с началом формирования тромба и служит для ограничения размеров возникающего кровяного сгустка.
Фибринолиз также не позволяет хаотически возникающим в организме процессам тромбообразования привести к ненужной закупорке сосудов, подавляя их на самой ранней стадии. В этом случае он работает как система «исправления ошибок» свертывания крови.
Наиболее заметная задача фибринолиза заключается в том, что он участвует в восстановлении органов и тканей после механического повреждения.
После того как кровопотеря остановлена процессом тромбообразования, начинаются процессы заживления поврежденных участков.
Для восстановления на этих участках требуется нормальное кровоснабжение, а значит, как можно скорее после заживления сосудистой стенки начинается фибринолиз — постепенное растворение тромба.
Пути активации фибринолиза
Растворение тромба в сосуде
Тромбы образуются в организме в ответ на изменение кровотока и повреждение сосудистой стенки (внутренний путь активации) и как следствие повреждения органов и тканей (внешний путь активации). Аналогично этому существуют два пути активации фибринолиза, они могут протекать в организме одновременно.
Тромб образован нитями белка-фибрина, который представляет из себя сетчатую структуру, способную задерживать в своих ячейках тромбоциты, эритроциты и другие элементы крови. Именно на каркасе из фибрина строится плотное вещество сгустка крови, способное перекрыть просвет сосуда и остановить кровотечение.
Для того, чтобы затем «убрать» больше ненужный тромб, организму требуется специальный набор растворителей — фибринолитическая система крови. Она состоит из главного фермента (плазмина), способного «разрезать» плотные нити фибрина, его предшественника (плазминогена) и веществ-активаторов превращения.
Плазминоген постоянно присутствует в крови наряду с некоторыми веществами-активаторами, однако для массового превращения молекул плазминогена в плазмин требуется большее, чем обычно, количество таких веществ (внутренний путь) или появление других активаторов, высвобождающихся из тканей (внешний путь).
Внешний путь
Внешний путь активируется при травме тканей и органов
Фибринолиз активируется по внешнему пути при помощи веществ, содержащихся в клетках сосудистой стенки, в тканях и некоторых кровяных клетках. К таким веществам в первую очередь относятся тканевой активатор плазминогена и урокиназа.
Внешний путь оказывается задействован при повреждении органов и тканей, из распавшихся клеток активаторы быстро поступают в кровь, ограничивая свертывающую систему крови и образование тромба. В здоровом организме тромб сразу формируется прикрепленным к сосудистой стенке, тромбообразование ограничивается местом травмы благодаря плазмину.
Внутренний путь
Баланс между процессами тромбообразования и фибринолиза
Этот путь активации фибринолиза подразделяется на зависимый и независимый от фактора Хагемана. ФХ (фактор Хагемана) — это компонент одновременно двух систем: тромбообразования и фибринолиза, благодаря этому зависимый от него внутренний путь активируется очень быстро, с самого начала свертывания крови.
При ФХ-зависимом внутреннем пути плазминоген оказывается переведен в активную форму тем же веществом, которое помогает синтезироваться нитям фибрина. Таким образом в месте формирования тромба сразу находится вещество, способное ограничить его размеры.
При сшивании мономеров фибрина в нити неизбежно образуются «обрывки», которые могли бы закупорить и другие сосуды, но ФХ (а также калликреин и ВМ-кининоген) способствует образованию плазмина как раз на месте протекания этого процесса.
Плазмин вновь «разрезает» ненужные куски фибриновых нитей до коротких D-димеров.
ФХ-независимый путь активации протекает благодаря другим веществам (калликреин и ВМ-кининоген), которые запускают превращение плазминогена в плазмин при отсутствии ФХ. Таким образом «обрывки» нитей могут быть удалены не только в процессе тромбообразования, но и значительно позже.
Угнетение фибринолиза
Фибринолиз может угнетаться при аутоиммунных заболеваниях
Снижение активности фибринолитической системы чаще всего связано с нехваткой главных веществ-активаторов, в норме постоянно присутствующих в крови: тканевого активатора плазминогена (ТАП) и урокиназы. Выработка этих веществ снижается при:
- Беременности;
- Приеме прогестерона и его аналогов;
- Болезнях сердечно-сосудистой системы (артериальная гипертензия, стенокардия, атеросклероз);
- Аутоиммунных болезнях (ревматоидном артрите, антифосфолипидном синдроме).
Злокачественные опухоли способны продуцировать вещества, снижающие активность ТАП и урокиназы.
Факторы, регулирующие фибринолиз
Избыток ингибиторов фибринолиза наблюдается при заболеваниях почек
Активность фибринолитической системы крови регулируется организмом при помощи специальных веществ-ингибиторов. К ним относится ПАИ-1, ПАИ-2, антиплазмин и ряд других веществ, редко определяемых в медицинских лабораториях из-за их малого диагностического значения.
Избыток ингибиторов фибринолиза наблюдается при:
- Системных васкулитах;
- ДВС-синдроме;
- Аутоиммунных заболеваниях;
- Болезнях почек;
- Лечении стрептокиназой.
Угнениение фибринолиза приводит к избыточному тромбообразованию, что может вызвать закупорку здоровых сосудов, повреждение органов и тканей из-за недостатка приносимого кровью кислорода.
Показатели фибринолиза при беременности
Поддержание гомеостаза при беременности — важно!
Значимые изменения со стороны свертывающей системы крови начинают проявляться со второго триместра беременности. Чаще всего фибринолиз угнетается, что имеет биологический смысл: так организм старается предотвратить возможную кровопотерю при родах или выкидыше. Однако чрезмерное подавление фибринолитической системы само по себе может провоцировать угрожающие жизни состояния:
- ДВС-синдром;
- Отслойку плаценты;
- Эклампсию;
- Тромбоз крупных и мелких сосудов.
Для предотвращения возможных последствий угнетения фибринолиза врачи проводят периодический контроль за показателями системы свертывания крови у беременных.
Оценить фибринолиз можно лабораторным путем
Нарушения со стороны системы фибринолиза выявляют в ходе следующих анализов:
- Определение времени Хагеман-зависимого фибринолиза — нормой является 4-10 минут до редукции тромба, увеличение времени растворения свидетельствует об угнетении фибринолитической системы.
- Нахождение плазминогена и его активаторов (ТАП) в плазме крови — нормальные значения составляют 71 — 101%;
- Определение в крови D-димеров — норма находится в диапазоне 33 — 727 нг/мл.
Показатели нормы могут различаться у лабораторий в зависимости от используемых тест-систем.
Синдром Хагемана

Анестезиолог-реаниматолог Юлия Егорова о синдроме нарушения свертывания крови, который повышает риск тромбозов и спонтанных выкидышей
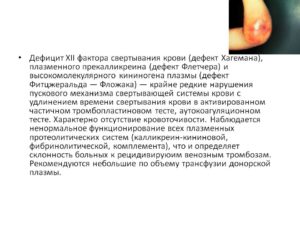
Дефицит фактора Хагемана (XII фактор свертывания крови) — это редкое (около 1:1 000 000 населения) и наследственно обусловленное нарушение коагуляционного гемостаза.
Наследуется этот дефект преимущественно аутосомно-рецессивно, но в единичных случаях — более тяжелых — выявляется аутосомно-доминантное наследование.
В иммунологических исследованиях было показано, что синдром Хагемана характеризуется сниженным синтезом фактора Хагемана, а не образованием его аномальных молекул.
В 1954 году в Кливленде (США) гематолог Оскар Ратнов наблюдал пациента Джона Хагемана 37 лет со значительно увеличенным временем кровотечения.
Обратив внимание на то, что, несмотря на изменения в коагуляции, пациент перенес хирургическую операцию без значительного кровотечения, Ратнов совместно с биохимиком Эрлом Дэйви установил, какого именно белка не хватало в плазме у этого пациента, заподозрив в этом причину нарушения свертываемости крови.
Этот сложный белок и был назван фактором Хагемана, а после того как английский гематолог Роберт Макфарлан в 1964 г. сформулировал каскадную теорию гемостаза, занял в ней место как 12‑й фактор свертывания.
Кровотечение — одно из самых опасных для организма состояний, защита организма от него должна быть как надежной, так и саморегулирующейся, чтобы остановка кровотечения не переходила в распространенный тромбоз. Эту роль выполняют сразу несколько систем — клеточная (тромбоцитарный гемостаз) и сложная система белков плазмы, состоящая из многих взаимосвязанных факторов свертывания:
- I — Фибриноген
- II — Протромбин
- III — Тканевой тромбопластин
- IV — Ионы кальция
- V — Проакцелерин
- VI — Акцелерин — изъят из классификации, так как является
активированным V фактором - VII — Проконвертин
- VIII — Антигемофильный фактор
- IX — Фактор Кристмаса
- X — Фактор Стюарта—Прауэра
- XI — Плазменный предшественник тромбопластина
- XII — Фактор Хагемана
- XIII — Фибринстабилизирующий фактор
- Фактор Флетчера — плазменный прекалликреин
- Фактор Фитцжеральда — высокомолекулярный кининоген
- Фактор Виллебранда — опосредует связывание тромбоцитов с субэндотелием
Фактор Хагемана — сиалогликопротеин — сложное органическое соединение, помимо белковой части включающее в себя олигосахарид и сиаловые кислоты.
Сиалогликопротеин синтезируется в печени, далее свободно и «без дела» циркулирует в плазме крови, пока не соприкоснется с отрицательно заряженными поверхностями, например, коллагеном поврежденной ткани или с калликреином, о котором стоит рассказать подробнее.
Калликреин — один из основных функциональных элементов сложной калликреин-кининовой системы, регулирующей процессы воспаления, свертывания крови, микроциркуляции и функции сосудистой стенки.
Фактор Хагемана, активированный повреждением ткани, участвует в запуске калликреин-кининовой системы, превращая прекалликреин в калликреин, а калликреин в свою очередь активирует все новые молекулы фактора Хагемана.
Получается петля для каскадного нарастания процесса. За счет этого небольшое количество поврежденных тканей вызывает реакцию в значительной части плазмы крови.
Кроме того, на 12 фактор (Хагемана) в активной форме действует 13 фактор (фибринстабилизирующий фактор), что запускает каскад биохимических реакций среди молекул, исходно присутствовавших в крови, — внутренний путь коагуляции. В отличие от внутреннего пути, внешний запускается попаданием в кровь тканевого тромбопластина из поврежденных тканей.
Таким образом, фактор Хагемана оказывается связующим звеном между процессами воспаления и свертывания крови; до его открытия связь этих процессов была гипотетической.
Клиническая картина
Клинически дефицит 12 фактора свертывания крови проявляется удлинением времени кровотечения без каких‑либо других симптомов нарушения гемостаза. Выраженность удлинения времени кровотечения зависит от типа наследования генетического дефекта.
При доминантном типе дефицит выражен сильнее, при рецессивном — частично компенсируется другими факторами свертывания. Время кровотечения увеличено из‑за замедленной инициации каскадной системы свертывания крови.
Склонности к патологическим кровотечениям пациенты не проявляют, поэтому заболевание часто не обнаруживают или обнаруживают случайно при лабораторном обследовании или предоперационном скрининге.
Немного парадоксальным кажется то, что при дефиците фактора свертывания проявляют себя не кровотечения, а тромбозы. Например, Джон Хагеман, по имени которого назван фактор свертывания, впоследствии погиб от тромбоэмболии, которой осложнился перелом костей таза.
Современные опубликованные клинические случаи оперативных вмешательств у пациентов с синдромом Хагемана, к счастью, заканчивались благополучно. Тромбофилические нарушения связаны с тем, что XII фактор участвует в разрушении тромбов путем активации калликреин-кининовой системы.
Активный калликреин не только запускает генерацию кининов, регулирующих воспаление, сосудистый тонус и болевые реакции, но и превращает неактивный белок плазминоген в активный фермент плазмин (фибринолизин), который и растворяет фибриновую часть тромба.
Поэтому с дефицитом фактора Хагемана ассоциированы:
- тромбозы
- мигрирующие тромбофлебиты
- тромбоэмболии
- инфаркты
- спонтанные аборты
Диагноз и прогноз
Кроме лабораторных исследований установить диагноз помогут анамнестические данные: склонность к длительным кровотечениям и тромботическим осложнениям у пациента и его родственников, а также положительный симптом Румпеля — Лееде (появление мелкоточечных кровоизлияний дистально от наложенного на плечо жгута). Прогноз при дефиците фактора Хагемана в большинстве случаев благоприятный, лечение не требуется. Коррекции это состояние требует только в связи с хирургическими вмешательствами. В качестве подготовки к операции может быть назначено переливание небольших доз свежезамороженной плазмы.
Период выведения донорского XII фактора — 48–56 ч.
Также при наличии этой коагулопатии следует уделять большее внимание профилактике тромботических осложнений: профилактическая компрессия нижних конечностей, УЗИ-контроль состояния вен нижних конечностей и малого таза, особенно при длительном постельном режиме.
В послеоперационном периоде для профилактики тромбозов необходимо назначение низкомолекулярных гепаринов, а для терапии кровотечений — отказ от применения ингибиторов фибринолиза, таких как аминокапроновая и транексамовая кислота.





