Мутации генов гемостаза MTHFR – что это значит и что с этим делать
Мутация гена MTHFR является проблемой, связанной с плохим метилированием и продукцией ферментов. Мутации генов гемостаза MTHFR влияют на каждого человека по-разному. Иногда они приводят к едва заметным симптомам, а иногда приводят к серьезным, долговременным проблемам со здоровьем.
Хотя точный показатель распространенности все еще остается предметом дискуссий, считается, что 30%-50% всех людей могут иметь мутацию в гене MTHFR, который наследуется и передается от родителя к ребенку.
Как правило, это гетерозиготная мутация. Приблизительно от 14% до 20% процентов населения могут иметь более тяжелую мутацию MTHFR, которая более резко влияет на общее состояние здоровья.
Она называется гомозиготной мутацией.
Разница состоит в том, что гетерозигота – это мутация в одной аллели пары генов. То есть шанс ее проявления составляет 50%. А гомозигота – мутация в обеих аллелях пары генов, проявление в 100% случаев.
Мутация гена MTHFR была обнаружена во время завершения проекта генома человека. Исследователи поняли, что люди с этим типом наследственной мутации имели большую вероятность развития определенных заболеваний. К ним относятся: СДВГ, болезнь Альцгеймера, атеросклероз, аутоиммунные расстройства и аутизм.
Еще многое предстоит узнать о том, что означает этот тип мутации для людей, которые несут ее и продолжают передавать своим детям.
На сегодняшний день существуют десятки различных состояний здоровья, связанных с мутациями MTHFR. Но еще раз подчеркнем, что даже если вы являетесь носителем мутации – не факт, что у вас будут ее проявления. Мутация означает лишь повышение рисков.
Что такое мутация генов MTHFR
MTHFR — это ген, который обеспечивает организм инструкциями по производству определенного фермента, называемого метилентетрагидрофолатредуктаза . То есть MTHFR — сокращенное название этого фермента.
Есть две основные мутации MTHFR, на которых исследователи фокусируются чаще всего. Эти мутации часто называют «полиморфизмами» и влияют на гены, называемые MTHFR C677T и MTHFR A1298C.
Также эти мутации называют – мутациями фолатного цикла, потому что они показывают, как организм преобразует фолиевую кислоту в активную форму для наилучшего усвоения.
Соответственно, если у вас есть мутации генов гемостаза MTHFR, то ваш организм плохо усваивает фолиевую кислоту и другие витамины группы B, особенно В12. Что делать в этом случае – читайте далее.
Мутации могут происходить в разных местах этих генов и наследоваться только от одного или обоих родителей. Наличие одного мутантного аллеля связано с повышенным риском определенных проблем со здоровьем, но наличие двух увеличивает риск намного больше.
Мутация гена MTHFR может изменить способ, которым некоторые люди метаболизируют и преобразовывают важные питательные вещества из своего рациона в активные витамины, минералы и белки.
Генетические мутации также могут изменять уровни нейротрансмиттеров и гормонов.
В некоторых случаях, хотя и не во всех, изменения в работе этого фермента могут влиять на параметры здоровья, включая уровень холестерина, функцию мозга, пищеварение, эндокринные функции и многое другое.
Часть о мутациях генов гемостаза MTHFR впервые узнают после анализа причин замершей беременности
1. Потребляйте больше натурального фолата, витамина В6 и витамина В12
В случае с мутациями генов фолатного цикла важно употреблять много продуктов, богатых витаминами B6, B9 и B12.
Вы также можете принимать их в виде добавки. Однако, помните, что людям с мутациями MTHFR труднее переводить синтетическую форму фолиевой кислоты в биодоступную. Более того, прием обычной фолиевой кислоты может вызвать ухудшение симптомов.
Получение достаточного количества фолиевой кислоты особенно важно до и во время беременности. За три месяца до зачатия и в течение первого триместра беременности матери, которые получают достаточно фолиевой кислоты, снижают риск развития у детей различных проблем со здоровьем.
Людям с мутациями MTHFR критически важно получать биодоступные формы фолата в добавках, называемых L-метилфолатом или метильной формой витамина В9.
L-метилфолат сложнее упаковывать в форме капсул, поэтому вы, возможно, не сможете получать очень высокие дозы в типичных поливитаминах или добавках. Поэтому рекомендуется принимать моно-добавки под называнием 5-MTHF.
Now Foods, Метилфолат, 5000 мкг, 50 вегетарианских капсул
Thorne Research, 5-МТГФ, 5 мг, 60 капсул
Если у вас обнаружена мутация MTHFR в форме гомозиготы, то метильные комплексы фолиевой кислоты вам необходимо пропивать постоянно курсами — минимум 3 раза в год.
Наличие большего количества фолиевой кислоты в вашем рационе означает, что вы лучше способны создавать активную форму 5-MTHF. Некоторые из лучших продуктов с высоким содержанием фолиевой кислоты включают в себя:
- Фасоль и чечевица
- Листовые зеленые овощи, такие как сырой шпинат
- Спаржа
- Ромэн
- Брокколи
- Авокадо
- Яркие фрукты, такие как апельсины и манго
Фолатный цикл, полиморфизм генов (MTHFR, MTR, MTRR)
Фолаты – производные фолиевой кислоты (витамина B9), играющие ведущую роль в широком спектре жизненно важных процессов: стимулируют эритропоэз, участвуют в синтезе аминокислот, нуклеиновых кислот, пуринов, пиримидинов, витаминов, участвуют в обмене холина, гистидина, в метилировании ДНК и РНК, способствуют регенерации мышечной ткани, развитию быстро растущих тканей (кожа, оболочки ЖКТ, костный мозг), выполняют защитную роль при беременности от тератогенных и повреждающих факторов на плод, способствуют созреванию и функционированию плаценты, оказывают эстрогеноподобное действие. Данные функции реализуются в процессе Фолатного цикла – это каскадный процесс синтеза аминокислоты метионина из гомоцистеина, контролируемый 3-мя ферментами: метилентетрагидрофолатредуктазой (MTHFR), метионин-синтазой (MTR) и метионин-синтаза-редуктазой (MTRR). В фолатном цикле фолаты являются коферментами. Главные причины нарушения фолатного цикла: 1. Генетические дефекты ферментов фолатного цикла MTHFR, MTR и MTRR. 2 Дефицит витаминов: фолиевой кислоты, витаминов В6 и В12, участвующих в обмене фолатов. Генетические дефекты ферментов приводят к снижению их функциональной активности, нарушению фолатного цикла, накоплению гомоцистеина в клетках и повышению уровня гомоцистеина в плазме крови, который оказывает выраженное тромбофилическое, токсическое, атерогенное действие и обусловливает повышенный риск развития ряда патологических процессов: * Осложнения беременности (фетоплацентарная недостаточность, преждевременная отслойка нормально расположенной плаценты, поздний гестоз) * Пренатальная смерть и дефекты развития плода (незаращение нервной трубки, анэнцефалии, деформации лицевого скелета) * Сердечно-сосудистые заболевания (ишемическая болезнь сердца, атеросклероз, инфаркт миокарда, тромбозы) * Канцерогенез (колоректальная аденома, рак молочной железы и яичника) и усиление побочных эффектов при химиотерапии * Эктопия хрусталика * Остеопороз
Показания для назначения
1. Акушерская патология: привычное невынашивание, антенатальная гибель плода, поздние гестозы, преждевременная отслойка плаценты, неудачные попытки ЭКО, синдром задержки внутриутробного развития плода, рождение ребенка с изолированными пороками нервной трубки, сердца или урогенитального тракта.
2.
Плановая подготовка к беременности при отягощенной наследственности (с акушерской патологией и сосудистым тромбозом в анамнезе, наличие родственников первой степени родства с наследственной тромбофилией и сердечно-сосудистыми катастрофами, особенно в раннем возрасте и др.)
3.
В гинекологии: планирование или применение гормональной контрацепции, гормональной заместительной терапии у женщин, имеющих тромбозы в анамнезе и/или родственников первой степени родства с наследственной тромбофилией и тромбоэмболическими осложнениями, при планировании гинекологических операций.
4.
Наличие сосудистого тромбоза в анамнезе: единичный тромбоз до 50 лет, повторные тромбозы, тромбозы необычной локализации (портальные, брыжеечные, мозговые вены), случаи наследственной тромбоэмболии и тромбоза в любом возрасте.
5. Сердечно-сосудистые заболевания: ишемическая болезнь сердца, артериальная гипертензия, атеросклероз и др.
6.
Ситуации высокого риска: повышенный уровень гомоцистеина в крови (гипергомоцистеинемия), массивные хирургические вмешательства — перед трансплантацией, эндопротезированием и др., длительная иммобилизация, семейная предрасположенность к онкологическим заболеваниям и назначение химиотерапии.
Маркер
Маркер генетических мутаций фолатного цикла.
Клиническая значимость
Исследование Полиморфизм генов Фолатного цикла (MTHFR, MTR, MTRR) проводится для диагностики причины и риска развития тромбофилии, связанной с нарушением обмена фолиевой кислоты и гипергомоцистеинемией.
Анализ полиморфизмов в генах фолатного цикла позволяет определить предрасположенность к опасным для жизни заболеваниям, связанным с нарушением обмена фолиевой кислоты, гипергомоцистеинемией и дает возможность своевременно назначить корректирующую терапию
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Биологический материал
Условия доставки
Контейнер
Объем
Цельная кровь
Условия доставки:
24 Час. при температуре от 2 до 8 градусов Цельсия
Контейнер:
Система с ЭДТА без разделительного геля
Стандартные условия: утром до 11.00, натощак, через 8-12 часов периода голодания. Особой подготовки не требуется. Важно: !!!Не курить в течение 30 минут до сдачи крови.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Не обнаружена.
- Не обнаружена.
Интерпретация:
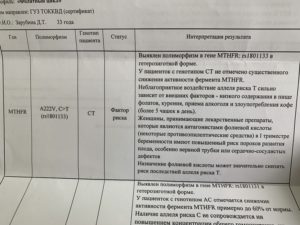
- Генетическое исследование выявляет в определенном участке ДНК замену нуклеотида, приводящее к замене аминокислотного состава белка и соответственно изменению биохимических свойств фермента.В результате нуклеотидных замен в кодирующем гене фермента снижается его функциональная активность.
Выявляют несколько вариантов генотипа (сочетание аллелей гена), влияющих на изменение функции кодируемого им фермента: аллель «нейтральный» – нормальная активность фермента, «гетерозигота по мутантному аллелю» — сниженная активность фермента, «гомозигота по мутантному аллелю» — значительно сниженная активность фермента.
Сниженная активность фермента приводит к нарушению метаболического пути превращения гомоцистеина, увеличению его содержание в плазме крови (гипергомоцистеинемии) и вероятности развития патологических состояний.
Образец результата (PDF)
Полиморфизмы генов фолатного цикла и беременность

Как только у женщины появляются мысли стать мамой, то она обращается в женскую консультацию для полного обследования. И в первую очередь врач назначает фолиевую кислоту. Насколько важна роль этого витамина для организма, что такое фолатный цикл и в чем заключается опасность при полиморфизме генов?
Для начала разберемся, что такое полиморфизм генов. Гены у разных людей похожи, но имеют небольшие нюансы, которые и отличают нас друг от друга. Эти нюансы, различия и называются полиморфизмами.
Причиной полиморфизма генов являются изменения отдельных участков в молекуле ДНК, что приводит к изменению свойств гена (иногда в лучшую, а иногда — в худшую сторону). Некоторые изменения ведут к генетическим заболеваниям, другие не влекут за собой болезни, но являются фактором предрасположенности к ряду патологий.
А что же такое фолатный цикл? Фолатный цикл – это совокупность процессов, в результате которых при помощи ферментов и коферментов из гомоцистеина появляется незаменимая аминокислота метионин.
Ферменты — это вещества, ускоряющие биохимические процессы в организме. В фолатном цикле принимают участие 3 фермента:
- метилентетрагидрофолатредуктаза MTHFR (для перевода фолиевой кислоты в активную форму);
- метионин-синтаза-редуктаза MTRR (влияет на активность метионин-синтазы);
- метионин-синтаза MTR (осуществляет превращение гомоцистеина);
Коферменты — это производные витаминов, необходимые для функционирования ферментов.
Коферментами являются фолаты, а для обмена фолатов необходимы витамины:
- В9 (фолиевая кислота);
- В6 (пиридоксин);
- В12 (цианокобаламин).
Фолатный цикл обеспечивает нормальное функционирование органов и систем. При мутации в генах происходит замена одного нуклеотида на другой, изменения числа повторяющихся фрагментов ДНК. Это все ведет к изменению биохимических свойств фермента и его функции, в результате чего нарушается превращение гомоцистеина в метионин.
Сбой в фолатном цикле влечет за собой увеличение концентрации в крови гомоцистеина, оказывающего на организм токсическое, атерогенное и тромбофиличское действие. Иными словами, возрастает риск некоторых осложнений беременности (например, гестоза или отслоения плаценты) и возникновения дефектов у плода.
Из-за чего может нарушиться метаболизм гомоцистеина и произойти сбой в фолатном цикле?
- генетические дефекты ферментов;
- дефицит витаминов вследствие недостаточного поступления с пищей или на фоне приема лекарственных средств (эстрогенсодержащих оральных контрацептивов, цитостатиков, противоэпилептических средств).
Кроме того, повышенный уровень гомоцистеина может быть при хронических заболеваниях: почечной недостаточности, анемии, псориазе, гипотиреозе; злокачественных опухолях яичников, молочной и поджелудочной желез.
Информация о ферментах фолатного цикла (MTHFR, MTRR, MTR) содержится в генах, которые именуются генами фолатного цикла. Эти гены могут иметь свои особенности у каждого человека — полиморфизмы. Исследование полиморфизмов в таких генах способно выявить, есть ли в конкретном случае риск нарушения фолатного цикла.
Важно! Не все полиморфизмы в генах фолатного цикла могут приводить к повышению гомоцистеина.
Диагностика полиморфизмов генов фолатного цикла
Исследование на полиморфизм генов фолатного цикла проводят методом полимеразной цепной реакции. Кровь для анализа лучше сдавать утром натощак, последний прием пищи должен быть накануне вечером.
Расшифровку данных полиморфизма генов фолатного цикла (MTR, MTRR, MTHFR) проводит только врач. Даже при выявленном полиморфизме не надо отчаиваться — это говорит только о предрасположенности к заболеванию и не означает, что в течение беременности обязательно будут осложнения.
Полиморфизмы генов фолатного цикла: в чем риск для матери и плода?
Уровень гомоцистеина при нормально протекающей беременности чуть понижается, составляя 4,6-12,4 мкмоль/л, и восстанавливается только после родов. Но при нарушениях в фолатном цикле он повышается и может оказывать токсическое, тромбофилическое и атерогенное действие.
Все это приводит к развитию различных патологических процессов со стороны матери и плода:
- угроза прерывания беременности;
- неудачное ЭКО;
- неразвивающаяся беременность;
- фетоплацентарная недостаточность;
- хроническая внутриутробная гипоксия плода;
- поздний гестоз;
- внутриутробная задержка роста и развития плода;
- пороки развития плода (дефекты нервной трубки, деформация лицевого скелета с незаращением неба и верхней губы, анэнцефалия);
- повышается риск развития синдрома Дауна.
Планирование беременности при полиморфизмах генов фолатного цикла
При планировании беременности важно выявить возможные хромосомные аномалии, в том числе носительство полиморфизма генов гемостаза и фолатного цикла.
Чтобы исключить наличие какой-либо патологии, обязательно надо посетить акушера-гинеколога. При опросе врач досконально соберет анамнез и при необходимости назначит дополнительное обследование, консультацию генетика.
Уровень гомоцистеина проверяют, если:
- предыдущие беременности завершились неблагоприятным исходом;
- у женщины повышенная свертываемость крови;
- у родственников будущей мамы были тромбозы, инфаркты или инсульты до 50 лет.
Важно! В течение 2-3 месяцев до зачатия всем женщинам совместно с партнером рекомендуют пропить фолиевую кислоту в профилактической дозе 0,4 мг/сутки.
Ведение беременности при полиморфизмах генов фолатного цикла
При наступлении беременности фолиевую кислоту продолжают пить до 12 недель включительно, что обеспечивает снижение риска нарушений со стороны нервной системы плода. Витамин выпускается в таблетках по 1 мг, назначают по 1 таб/сутки.
При полиморфизме дозировка может увеличиваться до 5 мг/сутки, а прием продолжают в течение всей беременности совместно с витаминами группы В. В критические сроки проводят дополнительную терапию.
Врач-генетик может порекомендовать принимать не обычный В9, а фолиевую кислоту в активной форме.
В чем разница? Дело в том, что в чистом виде фолиевая кислота организмом не усваивается — для этого она должна преобразоваться в определенную форму — метилфолат.
При мутации некоторых генов процесс превращения В9 в усвояемую форму нарушен, поэтому обычная фолиевая кислота усваивается плохо. В этом случае препаратом выбора становится ее активная форма — L-метилфолат, который легко всасывается в кровь без каких-либо преобразований.
Рекомендуют употреблять больше пищи с витамином В9 – шпинат, брокколи, горошек, авокадо, банан, арахис, бобовые, белый рис, хлеб из муки грубого помола, печень, мёд, томатный и апельсиновый соки.
В обязательном порядке контролируют уровень гомоцистеина в динамике, коагулограмму.
Врач-гинеколог о гомоцистеине при планировании беременности.
Роды при полиморфизмах генов фолатного цикла
В большинстве случаев на фоне профилактических мероприятий и проводимой терапии роды проходят хорошо.
Но могут быть следующие осложнения:
- преждевременные роды;
- преэклампсия, когда показано оперативное вмешательство в экстренном порядке;
- преждевременная отслойка нормально расположенной плаценты;
- кровотечение.
Главное, не переживайте и соблюдайте все рекомендации.
В послеродовом периоде до окончания кормления грудью продолжайте прием фолиевой кислоты по 0,4-1 мг/сутки.
Владлена Размерица, акушер-гинеколог, специально для Mirmam.pro
Генетические анализы при потерях беременности
Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
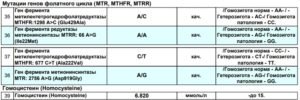
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.
Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Фолатный цикл. Исследование полиморфизмов в генах: MTHFR (A222V, C>T), MTHFR (E429A, A>C), MTR (D919G, A>G), MTRR (I22M, A>G), SLC19A1 (H27R, A>G)

array(20) { [«catalog_code»]=> string(6) «180016» [«name»]=> string(189) «Фолатный цикл. Исследование полиморфизмов в генах: MTHFR (A222V, C>T), MTHFR (E429A, A>C), MTR (D919G, A>G), MTRR (I22M, A>G), SLC19A1 (H27R, A>G)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.
» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3071» [«url»]=> string(56) «folatnyj-cikl-issledovanije-polimorfizmov-v-genah_180016» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
» [«opisanie»]=> string(10991) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Исследование полиморфизмов в генах:
- MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133
- MTHFR (метилентетрагидрофолатредуктаза, E429A , A>C), rs1801131
- MTR (метионинсинтаза, D919G, A>G), rs1805087
- MTRR (метионинсинтазаредуктаза, I22M, A>G), rs1801394
- SLC19A1 (транспортер фолатов, H27R, A>G), rs1051266
В данной панели исследуются факторы свертывающей системы крови, ассоциированные с дефектами ферментов фолатного цикла, которые в свою очередь влияют на состояние стенок сосудов, впоследствии приводящие к тромбофлебическим состояниям.
Генетические дефекты ферментов фолатного цикла (MTHFR, MTR, MTRR) особенно в сочетании с дефицитом в организме фолиевой кислоты и витаминов В6 и В12 приводят к нарушению фолатного цикла, что в свою очередь влечет за собой накопление гомоцистеина в клетках и повышение его уровня в плазме.
Гомоцистеин обладает тромбофилическим действием, а также выраженным токсическим и атерогенным действием, что повышает риск развития ряда патологических процессов, таких как усиление побочных эффектов при проведении химиотерапии и повышение риска возникновения сердечнососудистых заболеваний (ишемическая болезнь сердца, инфаркт миокарда, атеросклероз, венозные тромбозы).
Дефицит в организме витаминов В6 и В12 усиливает негативный эффект полиморфизмов в генах фолатного цикла.
Ген SLC19A1 является транспортером фолатов. Участвует также в поддержании внутриклеточной концентрации фолатов. Мутации в этом гене связаны с дефектами нервной трубки и расщелиной губы и/или неба у плода во время беременности. Мутации в гене влияют на возникновение побочных эффектов при терапии метотрексатом.
Определение нуклеотидной последовательности соответствующих генетических локусов проводится методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Преимущества метода:
- высокая прогностическая значимость выявляемых факторов риска;
- точность определения генотипа;
- анализ на наличие мутаций достаточно провести 1 раз в жизни.
Показания к исследованию:
- Гипергомоцистеинемия (повышенный уровень гомоцистеина в крови);
- Планирование беременности;
- Невынашивание беременности, гибель плода во 2 и 3 триместрах беременности;
- Рождение ребенка с изолированными пороками нервной трубки, сердца или урогенитального тракта;
- Ишемическая болезнь сердца, артериальная гипертензия, атеросклероз, венозный тромбоз;
- Тромбоэмболии;
- Антифосфолипидный синдром;
- Семейная предрасположенность к онкологическим заболеваниям;
- Назначение химиотерапии;
- Назначение оральных контрацептивов и гормональной заместительной терапии.
Интерпретация результатов:
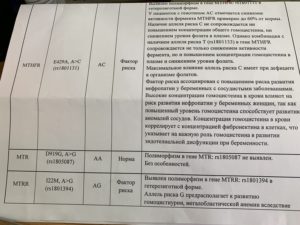
Для каждого полиморфизма в бланке ответа в графе «Результат» указывается его аллельное состояние: «Гетерозигота» или «Гомозигота».
Пример результата исследования. Выявление полиморфизмов в генах, связанных с фолатным циклом
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133 | CT |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, E429A , A>C), rs1801131 | AC |
| Полиморфизм в гене MTR (метионинсинтаза, D919G, A>G), rs1805087 | AG |
| Полиморфизм в гене MTRR (метионинсинтазаредуктаза, I22M, A>G), rs1801394 | AG |
| Полиморфизм в гене SLC19A1 (транспортер фолатов, H27R, A>G), rs1051266 | AA |
Нарушение фолатного цикла

статьи: Нарушение фолатного цикла – это сбой в процессе синтеза метионина и гомоцистеина – важных аминокислот.
У беременных подобное явление опасно развитием тотальной интоксикации организма не только самой женщины, но и плода.
Повышается вероятность развития состояний, при которых ребенок не развивается, гибнет или у него появляются серьезные дефекты. Исследование полноценности фолатного цикла (ФЦ) относится к одному из генетических анализов.
Суть нарушения фолатного цикла
Фолаты – это вещества, производные фолиевой кислотой, которая также определяется как водорастворимый витамин B9. Их роль в организме: 1. Вырабатывают новые эритроциты. 2. Принимают участие в синтезе аминокислот. 3. Запускают процесс созревания плаценты. 4. Восстанавливают мышечные волокна. 5.
Уравновешивают количество женских половых гормонов в крови. Нарушение фолатного цикла и эстрогены – взаимосвязаны: фолиевая кислота частично заменяет собой эти биологически активные вещества. Поэтому при заместительной гормональной терапии женщинам нередко назначают прием витамина B9. 6. Воздействуют на развитие быстро растущих тканей.
Также фолаты защищают ткани плода от неблагоприятного воздействия со стороны окружающей среды или материнского организма. Полиморфизм, предрасполагающий к нарушению фолатного цикла, – сбой в выработке ферментов MTHFR, MTRR, MTR.
В этом случае концентрация гомоцистеина в крови возрастает до 4,6-12,4 мкмоль/л, что влечет множественные осложнения для матери и ребенка. Причина полиморфизма генов – сбой, происходящий на отдельных сегментах молекулы ДНК, что влечет изменения характеристик гена в лучшую или худшую сторону.
Во втором случае создается благоприятное условие для развития различных генетических болезней. Причины нарушения фолатного цикла Основные причины появления сбоев в ФЦ: • Генетические дефекты ферментов MTHFR, MTR, MTRR. • Выраженная недостаточность фолиевой кислоты в организме.
• Дефицит в крови пиридоксина и цианокобаламина (витамина B6 и B12).
Факторы, вызывающие нарушение фолатного цикла в гомозиготной форме или гетерозиготном виде такового: курение, алкоголизм, гемодиализ, некорректная и строгая диета, болезни почек. Дополнительные причины – злокачественные опухоли желудка, поджелудочной железы и кишечника; хронические инфекционные процессы.
Доказано, что ФЦ может нарушиться из-за слишком долгого приема Метотрексата или препаратов противосудорожного свойства. Указанные лекарства ухудшают процесс всасывания производных фолиевой кислоты. Также сбой в ФЦ вызывает гастрит и колит – воспаление желудка и кишечника, при котором нарушается всасывание витамина B9.
Чем опасно нарушения фолатного цикла у беременных, диагностика
Наиболее распространенные последствия нарушения фолатного цикла – проблемы в развитии беременности: • Выкидыш.
• Неудачное экстракорпоральное оплодотворение.
• Физические пороки развития у плода.
• Поздний гестоз.
• Отслойка или недостаточное развитие плаценты.
• Высокий риск развития синдрома Дауна.
• Внутриутробная гипоксия.
Раннее выявление генетических аномалий у плода – одна из причин, почему беременной следует как можно раньше стать на учет в женскую консультацию. Врач назначает прохождение исследования крови. Оно позволяет выявить нарушение фолатного цикла в гетерозиготной форме или гомозиготном варианте такового.
Анализ на полиморфизм генов ФЦ выполняют путем использования метода ПЦР (полимеразной цепной реакции). Кровь для исследования нужно сдавать строго утром, натощак. Интерпретацию результатов MTR, MTRR, MTHFR выполняет только врач. При обнаружении полиморфизма женщине следует помнить, что нарушение фолатного цикла и беременность – несовместимые факторы.
Поэтому изначально нужно устранить основное состояние, которое потенциально способно вызвать развитие осложнений у ребенка. Мутация гена MTHFR C677 способствует накоплению гомоцистеина в крови. Во время беременности женщине с таким генетическим дефектом назначают исследование крови на определение гомоцистеина и свертываемости крови.
Второй вид диагностики рекомендуется проходить минимум 1 раз в 2,5-3 недели. Когда устанавливают, что показатель фибриногена равен 5 и выше – пациентке назначают инъекционное введение антикоагулянтов.
Цель анализа, показания для его прохождения
Исследование ФЦ представляет прогностическую ценность. Анализ мутаций в генах позволяет определить вероятность появления сердечно-сосудистых патологий, болезней репродуктивной системы, пороков физического развития у плода.
Женщине назначают лабораторное исследование крови на определение ФЦ, если актуальны следующие факторы: • Высокая вероятность появления у плода изолированного порока нервной трубки и сердца, сбой в развитии отделов мочевыделительной системы. • Риск появления у ребенка хромосомных синдромов, несмотря на наличие нормального кариотипа у родителей.
• Наличие тромбоза, ишемической болезни сердца непосредственно у пациентки или ее близких родственников. Во втором случае исследование генетического нарушения фолатного цикла позволяет определить риск развития указанных болезней у плода. • 2 и более случаев невынашивания плода или другие проблемные состояния, связанные с беременностью. • Антифосфолипидный синдром.
• Беременность после 40 лет. • Скорое прохождение курса химиотерапии. • Генетическая предрасположенность к развитию рака. Также анализ мутаций в генах фолатного цикла назначают в рамках плановой подготовки к беременности или перед прохождением гормональной терапии заместительного типа.
Преимущество метода диагностики в том, что генетические дефекты, возникшие у плода, удается выявить еще на этапе его внутриутробного развития. Почти все болезни, которые обнаруживает тест на нарушение ФЦ – показание для прерывания беременности.
Лечение нарушения фолатного цикла
Основную часть лечения нарушения фолатного цикла составляет корректирующее воздействие пищевыми добавками и изменение рациона. При гетерозиготной форме сбоя в гене MTHFR назначают прием фолиевой кислоты, поскольку ее усвоение сокращено на 25%-30%. При гомозиготном типе нарушения показано использование метилтетрагидрофолата (это активная форма фолиевой кислоты).
Противопоказан одновременный прием добавок, содержащих обычный витамин B9. Прием сразу активной и простой фолиевой кислоты при нарушении фолатного цикла признан неэффективным – 2 формы нарушают всасывание друг друга. Мутация MTRR предполагает использование повышенного количества витамина B12.
С учетом ответов пройденного исследования, рекомендуют использование сублингвальной (подъязычной) формы цианокобаламина до 8 раз/сутки. При мутации CBS назначают питание с низким содержанием метионина и серы, поскольку эти компоненты вызывают стрессовую реакцию и кортизоловый ответ. Из добавок исключают серосодержащие аминокислоты: Таурин, Метионин, Цистеин.
Противопоказано использование широкого спектра препаратов, предназначенных для поддержки печени. Такие лекарства неблагоприятно воздействуют на организм пациентов с мутацией гена CBS. Активную форму пиридоксина нужно принимать осторожно, поскольку при проблемном ФЦ витамин B6 влечет возбуждение нервной системы. Таким пациентам желательно получать соединение только из рациона.
При мутации гена CBS допустимо небольшими дозами принимать куркумин. Использование Глутатиона или Глютамина противопоказано до момента нормализации баланса серы в организме. Симптоматика, которая указывает на токсическое воздействие этого элемента: наличие поврежденных капилляров, кровоподтеки на теле. Дополнительно снижается функциональная активность почек.
Перенасыщение крови серой опасно сбоем метаболических процессов глюкозы в организме. Это влечет выброс инсулина, увеличение уровня сахара. Дополнительно врач назначает поддерживающую терапию для щитовидной железы и надпочечников.
Независимо от вида нарушенного ФЦ, рекомендовано использование молибдена, цинка, магния, кислоты Омега-3, аскорбиновой кислоты.
Также для нормализации концентрации фолатов в организме следует прекратить употребление алкоголя, улучшить качество питания, избегать стрессов.